Parte IV: electroforeses em gel de amido
A — Preparação do gel
1) Materiais e reagentes
As soluções foram preparadas a partir de reagentes pro analysis, excepto nos casos do amido
hidrolisado para electroforese e da polivinilpirrolidona (PVP).
A água utilizada nas soluções provinha da canalização pública, sendo submetida a pré-filtragem,
sucessivamente por um filtro de partículas e por um filtro de carvão activado, para depois ser desionizada
numa resina de troca iónica “mixed bed” (Permutit, Paramus, NJ) [Ganzi 1984, Hill & Lorch 1981]. A
qualidade desta água era regulada pela sua condutividade, que no decurso deste trabalho esteve quase
sempre nos 0 µS (o máximo tolerável sendo 2 µS).
2) Formação do gel
Solução de amido
Cada gel foi preparado em 300 mL do tampão respectivo (cf. secção B2). A matriz de amido era
constituída por uma mistura a 1:1 de dois tipos diferentes de amido hidrolisado [May 1991] obtido da
Sigma (números de catálogo S-4501 e S-5651, respectivamente mais consistente e mais fluido), a uma
concentração final de 11 % (16,5 g de cada por gel). A concentração escolhida foi o compromisso que
se encontrou entre viscosidade da solução no momento da sua transferência para o molde do gel,
integridade das fatias de gel após a electroforese, e economia de amido. Os dois primeiros factores são
cruciais para o sucesso de cada análise: na concentração de 14% sugerida por May [1991] havia algumas
dificuldades em obter repetidamente a desejável uniformidade de consistência e espessura do gel (pelo
menos com os materiais utilizados e na prática que a seguir se detalha), devido à excessiva viscosidade
da solução, e por outro lado a 10% acontecia facilmente quebrarem-se as fatias que eram separadas após
a electroforese. Não houve necessidade de peneirar o amido antes de pesá-lo [May 1991], pois
invariavelmente qualquer dos dois tipos se apresentavam sem agregações.
A preparação da matriz de amido envolvia suspendê-lo no tampão, ferver a solução e desgaseificá-la, para então poder transferir-se para o molde do gel. Existem várias opções para o aquecimento da
solução [Kephart 1990], tendo sido preferida a que May [1991] descreve, conforme é detalhado nos dois
primeiros passos do protocolo 2 (Apêndice III-A). Como em geral se preparavam 2 geis por dia, poderia
optar-se, como refere May [1991], por preparar dois géis a partir de 500 mL de tampão, distribuindo-se
a solução sequencialmente pelos dois moldes respectivos. A vantagem mais evidente desta estratégia está
na poupança de amido, mas a execução do protocolo tornava-se mais difícil, por isso preferiu-se preparar
dois geis de 300 mL separadamente.
Molde do gel
O molde do gel consistia duma placa de vidro temperado (246 mm × 206 mm × 4 mm) sobre a qual
se fixavam barras de vidro acrílico com largura de 19 mm, usando molas de escritório, deixando um
espaço de 206 mm × 168 mm adequado para a colocação de 40 amostras paralelamente ao lado maior
e a produção de três fatias replicadas (gel de 300 mL) [May 1991]. O sistema de barras podia ser disposto
de modo a produzir variantes da geometria do gel; por exemplo, quando se estava ainda a investigar o
potencial discriminante de cada actividade enzimática e era preferível um maior número de réplicas com
menor número de amostras, reduzia-se a área do molde.
Com o arrefecimento dentro do molde sobre uma superfície horizontal, à temperatura ambiente,
formava-se o gel. Logo que ganhava opacidade verificava-se se já estaria frio tocando-lhe com as costas
dos dedos, e caso estivesse retiravam-se as barras de vidro acrílico, cobria-se com película aderente para
impedir que houvesse mais evaporação, e guardava-se a 4 ºC até à colocação das amostras. A placa de
vidro temperado serve de suporte ao gel até ao fim da electroforese.
A perfeita horizontalidade do molde do gel era previamente verificada com um nível de bolha. Um
gel de espessura variável tem diferenças de condutividade eléctrica e de temperatura de que resultam
diferentes taxas de migração entre amostras. Além disso, quanto maior essa variação menor é a altura
do mesmo que se pode aproveitar para revelação (cf. parte V, secção A1).
3) Colocação das amostras
Procedimento
Cada extracto era transferido para o gel mediante a embebição dum rectângulo de papel Whatman
nº 1 com cerca de 1 cm × 0,3 cm, apenas até cerca de 2/3 do seu comprimento, para ser colocado na sua
posição pré-definida ao longo duma fenda no gel [May 1991].
A preparação dessa fenda era feita da seguinte maneira (figura 3.3): colocava-se o vidro de suporte
do gel sobre acumuladores de frio (para mant�-lo próximo dos 0 ºC), e destapava-se parcialmente,
dobrando sobre si mesma a película aderente na direcção perpendicular ao lado maior, até à posição onde
iria cortar-se a fenda. A parte destapada é a que depois fica orientada para o cátodo, e é sempre menor
que metade do comprimento (lado menor) do gel. Em seguida, passava-se um fio de pesca, esticado entre
as duas mãos, de modo a separar-se o gel do vidro, até à distância desejada; depois, mantendo-o
rigorosamente paralelo ao lado por onde foi introduzido, levantava-se a partir dum dos lados o fio de
pesca, de modo a cortar uma fenda onde haviam de ser colocados os aplicadores de papel de filtro
embebidos nos respectivos extractos. Deste modo, também se consegue o fácil deslizamento da parte que
se vai orientar para o cátodo, de modo a permitir a inserção das amostras, dispondo-as na parede do gel
virada do lado anódico para a fenda; no final da colocação dos aplicadores, deslizava-se de novo a parte
livre do gel para fechar a fenda e permitir o estabelecimento da corrente através do gel (protocolo 3,
Apêndice III-A). Pelo menos Micales et al. [1986] recomendam a separação do gel durante a aplicação
das amostras.
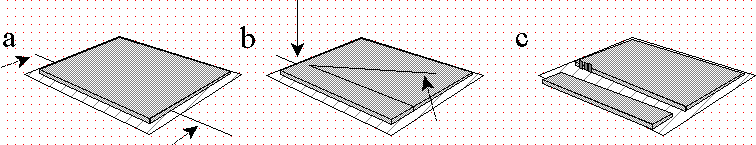 Figura 3.3 — Preparação do gel para a colocação das amostras. a) Passagem do fio de pesca
(movimento das setas) entre o gel (cinzento) e o vidro. b) Fixando o fio de pesca num dos lados
sobre o vidro (seta vertical), levanta-se a outra ponta de modo a abrir uma fenda no gel. c)
Deslizando a parte proximal, podem colocar-se as amostras (rectângulos de papel de filtro
embebidos nos respectivos extractos).
Figura 3.3 — Preparação do gel para a colocação das amostras. a) Passagem do fio de pesca
(movimento das setas) entre o gel (cinzento) e o vidro. b) Fixando o fio de pesca num dos lados
sobre o vidro (seta vertical), levanta-se a outra ponta de modo a abrir uma fenda no gel. c)
Deslizando a parte proximal, podem colocar-se as amostras (rectângulos de papel de filtro
embebidos nos respectivos extractos).
Considerações
Uma especial atenção era necessária:
• Ao tempo necessário a completar a transferência das amostras, podendo chegar a mais de 20
minutos por gel, assim exigindo manterem-se as amostras próximo dos 0 ºC, tanto no gel
(colocado sobre os acumuladores de frio) como nos tubos (imersos num banho de gelo, até à sua
reposição no congelador a -20 ºC mal se completavam as aplicações para um gel);
• À possibilidade de contaminação entre aplicadores adjacentes, até ao início da electroforese,
devido ao excesso de líquido — assim, houve o cuidado de retirar o excesso de líquido de cada
aplicador antes de colocá-lo de encontro ao gel, mesmo assim deixando 1/3 da sua superfície
seca para permitir a sua difusão no papel por capilaridade, só se fechando a fenda depois de
todas as amostras terem completado essa difusão.
A distância entre o lado a orientar para o cátodo e a fenda depende do espaço que se pretende
disponível para a migração de actividades enzimáticas no sentido do cátodo. Se a migração nesse sentido
não é expectável, então há toda a vantagem em usufruir do máximo de volume de gel do outro lado (para
o ânodo), até porque permite à frente do tampão migrando a partir do cátodo atingir mais cedo as
amostras, facilitando uma maior definição das bandas nos zimogramas. A largura da porção menor é,
nesses casos, a mínima necessária à colocação dos panos de celulose (cf. secção seguinte), isto é, 2,5–3
cm; caso contrário ela terá de ser maior, como foi o caso do presente estudo quando se preparava o gel
C (nomeadamente as actividades PER e também MDH, cf. “Resultados” parte II, secções A-1 e 2),
optando-se neste gel por deixar cerca de 6 cm de distância entre a fenda do gel e o lado do gel a virar
para o cátodo.
Para facilitar a identificação das amostras introduzia-se, em regra de 10 em 10, um espaço; e para
acompanhar o progresso da electroforese, incluia-se a seguir à 40ª uma amostra embebida em corante
alimentar (Condi Alimentar S.A., Camarate) [May 1991]; além disso, especialmente na investigação de
novas actividades enzimáticas (mas nem sempre nas análises de rotina), era frequente juntar uma amostra
de sangue humano entre a 20ª e 21ª amostras (com espaços de separação). O sangue utilizado era de
origem idónea e previamente verificado clinicamente, sendo útil por geralmente conter actividades
enzimáticas que serviam de controlo positivo para cada revelação, além de que o processo de extracção
envolvia uma solução muito mais simples (50 mM Tris pH 7,4 com 5 mM DTT e 25% etilenoglicol). A
posição do corante alimentar desaparecia sempre no decurso da revelação enzimática, por isso a posição
das actividades do sangue (e da hemoglobina) também era útil como padrão interno de migração dentro
do gel.
Em regra cada gel continha metade de amostras identificadas como azinheira e a outra metade
como sobreiro, intercaladas em grupos de 10 para optimizar a visualização de padrões discriminantes (10
Az – 10 Sb – 10 Az – 10 Sb, em que os traços representam os espaços de separação necessários a facilitar
a visualização). No caso da presença de amostras com híbridos e/ou seus descendentes (X), havia sempre
amostras de sobreiro e azinheira que eram colocadas em paralelo, em grupos de 5, com mesmo intuito
de facilitar a visualização de diferenças (5 Az|5 Sb – 10 X – 10 X – 5 Az|5 Sb).
B — Electroforese
1) Montagem do dispositivo de electroforese
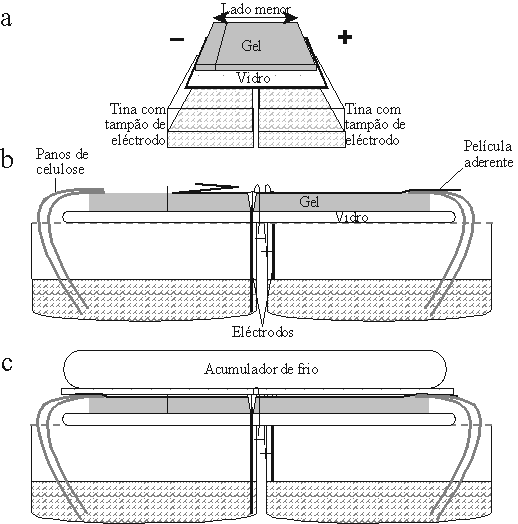 Figura 3.4 — Esquema da montagem do
dispositivo de electroforese. a) Disposição
do gel, sobre as tinas com os eléctrodos. b)
Alçado da montagem do dispositivo, no
momento em que se inicia o passo de
transferência das amostras para o gel. Note-se que a película transparente se encontra
parcialmente removida de modo a deixar os
aplicadores das amostras livres. c) Alçado
do dispositivo após a remoção dos
aplicadores, com reposição da película
aderente sobre toda a superfície do gel, e
colocação do acumulador de frio
intercalado por um vidro (início da fase de
separação da electroforese).
Figura 3.4 — Esquema da montagem do
dispositivo de electroforese. a) Disposição
do gel, sobre as tinas com os eléctrodos. b)
Alçado da montagem do dispositivo, no
momento em que se inicia o passo de
transferência das amostras para o gel. Note-se que a película transparente se encontra
parcialmente removida de modo a deixar os
aplicadores das amostras livres. c) Alçado
do dispositivo após a remoção dos
aplicadores, com reposição da película
aderente sobre toda a superfície do gel, e
colocação do acumulador de frio
intercalado por um vidro (início da fase de
separação da electroforese).
O desenho do dispositivo de electroforese baseou-se nas descrições de May [1991],
complementadas pelas de Kephart [1990] e de Micales et al. [1986]. Adaptaram-se recipientes de
plástico para servirem de tinas para o tampão de eléctrodo, montando-lhes eléctrodos de aço inoxidável
(Apêndice III-B). Cerca de 200 mL de tampão de eléctrodo eram colocados em cada tina e nele
embebidos panos de celulose (Wypall Lite, Kimberley Clarke código 7461), dobrados em metade, 2 por
eléctrodo. O vidro do gel era colocado sobre as tinas justapostas e um dos lados dos panos de celulose
colocados sobre o gel para formarem uma ponte com o tampão banhando os eléctrodos (figura 3.4 a, b).
Antes da aplicação da corrente verificava-se mais uma vez a possibilidade de alguma descontinuidade
localizada entre os dois eléctrodos, nomeadamente alguma abertura da fenda ou falha de contacto com
a ponte formada pelos panos de celulose.
Dava-se então início à fase de transferência das amostras para o gel, isto é, durante 10 a 15
minutos a corrente aplicada servia para promover a migração inicial das actividades enzimáticas para
dentro do gel. Após esta fase, retiravam-se os aplicadores, verificava-se de novo se haveria alguma
descontinuidade entre os dois eléctrodos, estendia-se a película aderente de modo a recobrir todo o gel,
e sobre este colocava-se uma placa de vidro e um acumulador de frio (o mesmo que serviu para refrigerar
o gel durante a colocação dos aplicadores), para concluir a montagem do dispositivo para a fase de
separação, isto é, a electroforese propriamente dita (figura 3.4 c).
2) Protocolos de separação de isoenzimas
O aquecimento do gel durante a electroforese limita a voltagem a utilizar e mesmo assim requer
que todo o processo decorra a frio para controlar a temperatura [May 1991], o que se conseguiu com o
acumulador de frio sobre o gel e mantendo o dispositivo de electroforese dentro de uma vitrine frigorífica
a 4 ºC. Por seu lado, o tempo necessário para a resolução dos isoenzimas é idealmente o mais curto
possível, em primeiro lugar pela cinética de desnaturação de cada proteína e depois pela progressiva
influência da difusão, com alargamento das bandas e redução da sua intensidade. Assim, a voltagem
aplicada não poderia ser demasiado baixa. As electroforeses realizaram-se com voltagem constante, e
o seu progresso monitorizado pela intensidade de corrente (amperagem) e migração do corante alimentar
(cf. secção A3).
A duração da electroforese varia com os diferentes sistemas de separação, tendo-se determinado
empiricamente tempos mínimos para assegurar a resolução das bandas. Só no caso do sistema R se
conseguia em tempo útil uma migração da frente do tampão até quase ao fim do gel, mas isso não era
forçosamente sinónimo de melhor resolução, especialmente se acompanhada de maior aquecimento.
Sistema “C”
Adaptado da fórmula de Clayton e Tetriak descrita por May [1991].
Tampão do eléctrodo: Ácido cítrico 50 mM, aproximadamente 1,15% (v/v) N-(3-aminopropil)-morpholine (Sigma A-9028) para dar pH 6,1; tampão do gel: tampão do eléctrodo 10 % (v/v) em água,
pH 6,1.
Electroforese: 300 V, 3 horas. Corrente geralmente entre 90 e 100 mA.
Sistema “R”
Também conhecido como sistema de Ridgway et al.. Formulação segundo May [1991], adaptada.
Tampão do eléctrodo: Ácido bórico 0,3 M, hidróxido de lítio 60 mM para dar pH 8,1; tampão do
gel: tampão do eléctrodo 1 % (v/v) em Tris 30 mM, Ácido cítrico 3,7 mM, pH 8,5.
Electroforese: 300 V, 2 horas e 30 minutos. Corrente inicialmente a 50–60 mA, decrescendo até
aos 28 mA perto do fim.
Sistema “H”
Adaptado da fórmula de Cheliak e Pitel descrita por Micales et al. [1986].
Tampão do eléctrodo: Tris 125 mM, ácido cítrico 40 mM para dar pH 7,0; tampão do gel: L-histidina 50 mM, EDTA 1,4 mM, HCl 4,5–5 mM pH 7,0.
Electroforese: 200 V, 2 horas e 15 minutos. Corrente inicialmente a 55–65 mA, decrescendo para
cerca de 40 mA.
Sistema “9”
Fórmula de Selander et al. descrita por May [1991].
Tampão do eléctrodo: Tris 10 mM, ácido maleico (Sigma M-0375) 0,1 M, EDTA 10 mM, MgCl2
10 mM, NaOH 0,12 M para dar pH 8,0; tampão do gel: tampão do eléctrodo 5 % (v/v) em água, pH 7
aproximadamente.
Electroforese: recomenda-se a voltagem de 200 V durante 2 horas e 30 minutos, com a amperagem
a atingir mais de 120 mA, exigindo muita vigilância da refrigeração.
Sistema “4”
Fórmula de Selander et al. descrita por May [1991].
Tampão do eléctrodo: Tris 0,223 M, ácido cítrico 94 mM, NaOH 50 mM para dar pH 6,3; tampão
do gel: Tris 8 mM, 3 mM ácido cítrico, 3 mM NaOH para dar pH 6,7.
Electroforese: geralmente a 200 V durante 3 horas, com a corrente inicialmente a 55–85 mA,
aumentando ligeiramente durante a electroforese. Este sistema coloca alguns problemas de temperatura
elevada no gel.
Sistema “M”
Fórmula de Market e Faulhaber descrita por May [1991].
Tampão do eléctrodo: Tris 0,18 M, ácido bórico 0,1 M, EDTA 4 mM, pH 8,7; tampão do gel:
tampão do eléctrodo 25 % (v/v) em água, pH 8,7.
Electroforese: a única tentativa decorreu a 300 V durante 3 horas, com corrente a 35 mA.
 Figura 3.3 — Preparação do gel para a colocação das amostras. a) Passagem do fio de pesca
(movimento das setas) entre o gel (cinzento) e o vidro. b) Fixando o fio de pesca num dos lados
sobre o vidro (seta vertical), levanta-se a outra ponta de modo a abrir uma fenda no gel. c)
Deslizando a parte proximal, podem colocar-se as amostras (rectângulos de papel de filtro
embebidos nos respectivos extractos).
Figura 3.3 — Preparação do gel para a colocação das amostras. a) Passagem do fio de pesca
(movimento das setas) entre o gel (cinzento) e o vidro. b) Fixando o fio de pesca num dos lados
sobre o vidro (seta vertical), levanta-se a outra ponta de modo a abrir uma fenda no gel. c)
Deslizando a parte proximal, podem colocar-se as amostras (rectângulos de papel de filtro
embebidos nos respectivos extractos).