Parte II: Material vegetal utilizado
A — Plantas criadas em viveiro
1) Colheita de sementes
Realizou-se a colheita de sementes para criação em viveiro maioritariamente durante a frutificação
de 1998, totalmente a cargo da Direcção Regional de Agriculura do Alentejo e da Estação Florestal
Nacional, embora na de 1997 as de algumas azinheiras do povoamento da Mitra também fossem
aproveitadas pelo autor.
Nos povoamentos de referência (Monte Branco, Azeiteiros e Testa) colheram-se lotes de sementes
do chão, apenas com a recomendação de que apenas algumas fossem colhidas debaixo de cada árvore
para na medida do possível aproximar a uma amostragem homogénea de cada um.
Já nas parcelas mistas, a mesma prática de colher do chão acarretou problemas de identificação
entre cada adulto e as descendências que lhe eram atribuídas. Esta questão tornava-se tanto mais
relevante quanto maior fosse a densidade local, ou mais altas as árvores, ou onde houvesse inclinação
do terreno. Como é detalhado nos mapas destes povoamentos (Apêndice I-B), na Mitra o quadrante
sueste é particularmente denso, assim como o são pequenas manchas de Feijoas (árvores 16–18 e 52,
26–28); algumas árvores, sobreiros em todos os casos, eram bastante altas (na Mitra, 2, 3, 5, 8, 10, 11,
16, 24, 27, 31; em Feijoas, 10, 17, 39, 41, 44, 46); e no caso da Mitra há um declive importante,
especialmente pronunciado no quadrante sueste e descendo na direcção de SSE para NNW, suavizando
até à árvore 12, enquanto em Alfaiates pode dizer-se que todas as árvores se situam num declive
acentuado, descendo no sentido de ESE para WNW. Conclui-se por isso que em qualquer um destes
povoamentos era provável haver contaminantes de família para família, detectáveis visualmente só
quando entre espécies diferentes.
A amostragem de 1998 não abrangeu todas as famílias presentes, apesar de (pelo menos para
sobreiro) ter sido um ano de boa produção de sementes; juntando a tendência de só as sementes caídas
mais recentemente estarem disponíveis, especialmente onde há pastoreio, à provável dispersão temporal
da deiscência, entre árvores, uma amostragem exaustiva iria exigir várias visitas a cada um dos
povoamentos mistos, que não foi possível realizar. Mesmo assim (tabela 3.1) pouco mais de metade das
árvores de cada espécie, em cada parcela, estiveram representadas por descendências.
2) Criação em viveiro
As sementes foram transferidas para os Viveiros de Santo Isidro (Pegões) onde foram logo
semeadas segundo as especificações de Varela et al. [2003a], excepto na utilização de turfa em vez de
casca de pinheiro, como substrato. Cada tabuleiro compõe-se de 50 alvéolos, e em regra continha plantas
duma única origem (família ou lote), identificada com etiquetas plásticas amarelas (cf. Apêndice I-C1).
A taxa de germinação não foi determinada, mas em regra a maior parte dos alvéolos estavam ocupados
com uma planta.
A Estação Florestal Nacional fez um mapa dos tabuleiros para facilitar o trabalho de localização
das sementeiras das diferentes origens.
Era notória a variação no crescimento entre plantas dum mesmo tabuleiro. Também se observaram,
na Primavera de 1999, algumas plantas albinas (descendentes dos sobreiros 11, 18 e 24 da Mitra), as
quais foram analisadas apenas a título de curiosidade (série de extracções número 7), verificando-se que
também expressam as actividades enzimáticas em análise. São muito mais fáceis de macerar e dão um
extracto esbranquiçado, excepto algumas que apresentavam um pigmento carmim e que no extracto
passava a verde.
3) Colheita de folhas
Para que fosse possível colher as folhas e obter os extractos no mesmo dia, foi necessário manter
os tabuleiros com plantas na Universidade de Évora, em estufas no pólo da Mitra, com rega diária por
aspersão. O transporte dos Viveiros de Santo Isidro para a Mitra e volta era a cargo do viveirista e
programado conforme o avanço no processamento dos tabuleiros existentes e o espaço disponível nestas
estufas. Os tabuleiros que eram pedidos de cada vez ao viveirista eram identificados em função do mapa
de sementeiras elaborado pela Estação Florestal Nacional (cf. secção anterior).
Numerou-se cada tabuleiro que era processado numa sequência numérica que atingiu o número
133 (14,89 plantas por tabuleiro, em média), colocando uma etiqueta com tinta impermeável num dos
lados. A identificação dos tabuleiros já processados ficava assim assegurada, e a sua orientação também,
de modo a tornar possível repetir a amostragem de qualquer planta.
As folhas eram retiradas à mão para dentro de sacos de plástico previamente identificados com
marcador de feltro, indicando o número do tabuleiro e o alvéolo, este referenciado a uma esquadrilha
conforme é esquematizado na figura 3.1. O número de sacos a utilizar em cada dia era previamente
determinado pela quantidade de tempo calculada como disponível para as extracções a realizar nesse
mesmo dia. Se por alguma razão as folhas colhidas não fossem processadas, as plantas em questão eram
reamostradas.
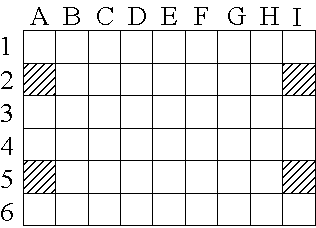 Figura 3.1 — Esquema dum tabuleiro utilizado para a sementeira e
crescimento das descendências incluídas no presente estudo (cf. Apêndice I
secção C1). Os alvéolos A2, A5, I2 e I5 nunca estavam preenchidos, pois
contêm pontos de apoio para o empilhamento dos tabuleiros.
Figura 3.1 — Esquema dum tabuleiro utilizado para a sementeira e
crescimento das descendências incluídas no presente estudo (cf. Apêndice I
secção C1). Os alvéolos A2, A5, I2 e I5 nunca estavam preenchidos, pois
contêm pontos de apoio para o empilhamento dos tabuleiros.
B — Material colhido directamente do campo
1) Adultos
A colheita de folhas foi realizada pelo autor do presente estudo directamente nas próprias árvores,
observando os mesmos princípios descritos na secção imediatamente precedente no que respeita à
identificação dos sacos e dimensionamento da amostragem a fazer em cada dia.
Obteve-se pelo menos uma vez um extracto de folhas de todas as árvores originalmente marcadas
nos povoamentos mistos, enquanto dos híbridos foi obtido em geral mais do que um.
2) Sementes
A amostragem de sementes para electroforese foi realizada no Outono de 2000 pelo autor do
presente estudo, colhendo-se directamente da árvore. Introduzidas em sacos de plástico devidamente
identificados quanto à origem, eram processadas no próprio dia ou no dia seguinte.
C — Codificação das amostras
Procurou-se que não fosse possível, pela disposição das amostras nos geis, identificar a sua origem
(isto é, o povoamento e a família), o que pareceu desde logo importante para que, em futuras aplicações
de rastreio, a avaliação dos zimogramas não fosse condicionada por essa informação. Convinha apenas
manter a distinção entre sobreiro, azinheira e híbrido, em referência à indicação de origem em cada caixa,
para assegurar um número equilibrado das duas espécies em cada gel.
Houve três níveis de codificação, o primeiro para identificar as plantas de viveiro e árvores-mãe
respectivas, o segundo para identificar cada tabuleiro, e o terceiro para identificar os extractos
enzimáticos. Estas codificações só se cruzavam no registo das extracções, permitindo que a análise dos
resultados de cada electroforese se fizesse sem conhecimento da origem de cada extracto. As regras
utilizadas foram as seguintes:
Primeiro nível
Esta codificação dizia respeito à identificação de cada adulto, família, ou lote, feita no acto da
sementeira e assinalada por uma etiqueta de plástico amarela enterrada num dos alvéolos:
• Populações de referência: Santiago do Cacém (sobreiros de Monte Branco), Azeiteiros/ Campo
Maior (azinheiras) e Testa
 (azinheiras). Nalguns registos usou-se a letra R seguida de c (“cork”)
ou h (“holm”), donde Rc, Rh1 e Rh2, respectivamente [Oliveira et al. 2003].
(azinheiras). Nalguns registos usou-se a letra R seguida de c (“cork”)
ou h (“holm”), donde Rc, Rh1 e Rh2, respectivamente [Oliveira et al. 2003].
• Parcelas mistas: uma letra designando a parcela (M para Mitra, F para Feijoas do Ramos e A
para Alfaiates), seguida do número da árvore-mãe respectiva, segundo a marcação feita in loco,
representada nos mapas respectivos (cf. Apêndice I-B). Por exemplo, F32 designava um
tabuleiro contendo descendência da azinheira 32 em Feijoas do Ramos, mas também essa mesma
azinheira.
• Híbridos: SM1 e SM2 (He. Outeiro
 ), e SES (Sesmarias).
), e SES (Sesmarias).
Segundo nível
Numeração dos tabuleiros, feita sequencialmente à medida que se iam fazendo as extracções (#1
até #133), com a identificação do alvéolo ocupado por cada planta. Para essa identificação, a letra
designando a coluna do alvéolo era minúscula se se tratava de proveniência de azinheira, ou maiúscula
em todos os restantes casos, independentemente da aparência da planta sugerir ser azinheira ou sobreiro.
Terceiro nível
Amostras ordenadas por séries numéricas (1 a 43), cada série correspondendo a uma preparação
única do meio de extracção. Caso acontecesse algum problema técnico relacionado com o passo de
extracção, ele poderia ser identificado como tal pelo facto das amostras trazerem o mesmo número de
série. Apenas no caso das árvores híbridas (ou suspeitas de tal) se adoptou uma numeração àparte,
sequencial desde X1 até X28.
Dentro das séries, as amostras de sobreiro eram identificadas individualmente com uma letra
maiúscula, por exemplo 22C (amostra C da série 22), enquanto para as de azinheira a letra era minúscula,
por exemplo 31t (amostra t da série 31). No final do alfabeto, a Z seguia-se AA, AB, etc., e a AZ seguia-se BA, etc.. No caso das descendências de híbridos, em lugar da letra utilizava-se um número, separado
do de série por um ponto, por exemplo 33.13 (amostra 13 da série 33).
Com este sistema, sempre que houvesse mais de uma extracção da mesma planta, a codificação
de cada réplica era diferente: por exemplo, 28f e 42a designaram as duas extracções da árvore adulta A11
(número 11 de Alfaiates).
No caso das plantas adultas, não havia lugar à identificação dos alvéolos e das caixas, bastando
o número da árvore e a parcela a que pertencia, e no caso dos híbridos a respectiva abreviatura (cf. parte
I secção C), portanto nestes casos fazia-se uma relação directa entre o 3º e o 1º nível de codificação.
Descodificação
O ordenamento das amostras no gel de eletroforese baseava-se em princípio no ordenamento das
séries, em geral em grupos de 10 azinheiras alternados com grupos de 10 sobreiros, com um espaço a
separar os grupos entre si. Para dar um exemplo típico deste arranjo, num gel foram ordenadas
sucessivamente as amostras 29a até 29j, 29A–J, 29k–t e 29K–T. Consultando o registo de extracções
(tabela 3.5), neste gel as amostras de azinheira eram do tabuleiro #30 (alvéolos b3–i6), de Testa, e do
tabuleiro #31 (alvéolos a1 e a3), de Azeiteiros, enquanto as de sobreiro eram todas do tabuleiro #29
(alvéolos A1–F5), de sementes colhidas sob o sobreiro A9. Note-se que só neste registo de extracções
se pode recuperar a proveniência de cada amostra.
Tabela 3.5 — Transcrição de parte do registo da série de extracções número 29. Cada uma das 5
colunas contém, sucessivamente, a designação da amostra (3º nível), alvéolo da planta correspondente
e número do tabuleiro (2º nível). A identificação da origem de cada tabuleiro (1º nível) é indicada no
texto que serve de cabeçalho à identificação das amostras. Por exemplo, a amostra 29m é uma azinheira
que ocupava o alvéolo f6 do tabuleiro #30, de material proveniente do povoamento de referência Testa.
7 FEV 2000
|
Início e conclusão dos contentores
 #29 e #30 de Alfaiates 9 e Testa
respectivamente, início do #31 de Azeiteiros.
#29 e #30 de Alfaiates 9 e Testa
respectivamente, início do #31 de Azeiteiros.
|
29A
|
A1
|
#29
|
29M
|
D6
|
#29
|
29Y
|
G6
|
#29
|
29e
|
c3
|
#30
|
29q
|
i4
|
#30
|
29B
|
A4
|
|
|
29N
|
E2
|
|
|
29Z
|
H1
|
|
|
29f
|
c4
|
|
|
29r
|
i6
|
|
|
29C
|
B2
|
|
|
29O
|
E3
|
|
|
29AA
|
H4
|
|
|
29g
|
c5
|
|
|
29s
|
a1
|
#31
|
29D
|
B3
|
|
|
29P
|
E5
|
|
|
29AB
|
H5
|
|
|
29h
|
c6
|
|
|
29t
|
a3
|
|
|
29E
|
C1
|
|
|
29Q
|
E6
|
|
|
29AC
|
H6
|
|
|
29i
|
e3
|
|
|
29u
|
a4
|
|
|
29F
|
C2
|
|
|
29R
|
F3
|
|
|
29AD
|
I1
|
|
|
29j
|
e4
|
|
|
29v
|
a6
|
|
|
29G
|
C3
|
|
|
29S
|
F4
|
|
|
29AE
|
I3
|
|
|
29k
|
f3
|
|
|
29w
|
b1
|
|
|
29H
|
C5
|
|
|
29T
|
F5
|
|
|
29AF
|
I6
|
|
|
29l
|
f4
|
|
|
29x
|
b2
|
|
|
29I
|
D1
|
|
|
29U
|
F6
|
|
|
29a
|
b3
|
#30
|
29m
|
f6
|
|
|
29y
|
b3
|
|
|
29J
|
D2
|
|
|
29V
|
G2
|
|
|
29b
|
b4
|
|
|
29n
|
h2
|
|
|
29z
|
b4
|
|
|
29K
|
D3
|
|
|
29W
|
G3
|
|
|
29c
|
b6
|
|
|
29o
|
h3
|
|
|
29aa
|
b5
|
|
|
29L
|
D5
|
|
|
29X
|
G5
|
|
|
29d
|
c2
|
|
|
29p
|
h4
|
|
|
29ab
|
b6
|
|
|
D — Fases da análise
Da frutificação de 1998 obtiveram-se descendências de 49 sobreiros e de 40 azinheiras das
parcelas mistas, distribuídas conforme descrito na tabela 3.6 (e também na tabela 3.1):
Tabela 3.6 — Distribuição das descendências disponíveis para análise pelas parcelas mistas em
estudo, destacando o número de árvores-mãe marcadas de cada espécie, o número destas que na
frutificação de 1998 deram frutos, constituindo famílias de meio-irmãos, e o número de amostras dessas
famílias que foram analisadas.
Parcela
|
Árvores-mãe
|
Sobreiros
|
Azinheiras
|
Marcados
|
Famílias
|
Amostras
|
Marcadas
|
Famílias
|
Amostras
|
Mitra
|
39
|
19
|
125
|
25
|
19
|
200
|
Feijoas
|
32
|
16
|
187
|
20
|
11
|
90
|
Alfaiates
|
20
|
14
|
348
|
20
|
10
|
191
|
Total
|
85
|
49
|
660
|
64
|
40
|
481
|
A estratégia inicial era analisar pelo menos uma caixa inteira, isto é, algumas dezenas de plantas
(tipicamente entre 25 e 45), por família. Mas o número de famílias era muito elevado e, face aos
resultados, optou-se a partir de certa altura por rentabilizar melhor o esforço analisando menos
exemplares de cada uma. Esta decisão justificou-se, tendo em conta os objectivos traçados, por três
ordens de razões:
i) A amostragem dalgumas dezenas por família não pareceu um requisito importante: já sendo
aparente a raridade de híbridos nesta frutificação, só com amostragens de centenas de
indivíduos por família poderia haver uma esperança razoável de conseguirem-se distinguir as
árvores-mãe em termos de susceptibilidade de os produzirem;
ii) A ocorrência ocasional de contaminantes entre as famílias, fossem eles mais evidentes nos
casos de plantas de azinheira entre sobreiros ou vice-versa, ou mais subtis quando revelados
por incongruências entre gerações em loci polimórficos (casos em que a planta não expressava
qualquer dos alelos existentes na presumida árvore-mãe), e que não era inesperada pelo facto
das sementes terem sido colhidas do solo (cf. secção A1), levou a que não pudesse ser
atribuída grande fiabilidade à filiação de cada planta, pelo que era destituída de qualquer
sentido a individualização de cada família para a detecção de hibridismo. Em princípio, cada
parcela teria de ser analisada globalmente;
iii) Parecendo ser a hibridação um evento raro, seria porventura mais útil assumir que se distribui
quasi-uniformemente pelas árvores da parcela, levando à necessidade de cobrir toda a
superfície da mesma, isto é, analisando representantes de todas as famílias disponíveis.
Assim, as famílias estiveram representadas em dois níveis de amostragem: as inicialmente
analisadas, com maior representação (descendentes das árvores 1, 13, 32, 37 e 60 da Mitra, 27, 28 e 34
de Feijoas, e 8, 9, 12, 20, 21, 29, 30, 31, 34, 36 e 38 de Alfaiates), e as restantes 70 famílias com
representação bastante limitada (cf. Apêndice IV-A).
 Figura 3.1 — Esquema dum tabuleiro utilizado para a sementeira e
crescimento das descendências incluídas no presente estudo (cf. Apêndice I
secção C1). Os alvéolos A2, A5, I2 e I5 nunca estavam preenchidos, pois
contêm pontos de apoio para o empilhamento dos tabuleiros.
Figura 3.1 — Esquema dum tabuleiro utilizado para a sementeira e
crescimento das descendências incluídas no presente estudo (cf. Apêndice I
secção C1). Os alvéolos A2, A5, I2 e I5 nunca estavam preenchidos, pois
contêm pontos de apoio para o empilhamento dos tabuleiros.