Parte II: Biologia da reprodução e genética dos Quercus
A — Polinização e fertilização
1) Desenvolvimento floral
As flores nos Quercus têm duas fases de desenvolvimento: a primeira consiste na diferenciação
do primórdio da inflorescência (feminina ou masculina) a partir da Primavera do ano anterior à
polinização [Cecich 1997a, Sork et al. 1993a], estacionando durante o Inverno já com os principais
órgãos florais diferenciados (carpelos, estames) [Cecich 1997a]; a segunda acompanha o
desenvolvimento da nova folhagem nas extremidades dos ramos na Primavera seguinte, e é nesta altura
que se dá a meiose nas anteras, antecedendo em 6 semanas a libertação do pólen [Cecich 1997a]. Esta
segunda fase pode ainda subdividir-se em estádios macroscopicamente diferenciáveis, a exemplo do que
foi definido em sobreiro [Varela & Valdivieso 1996], ordenados da seguinte maneira (figura 2.4):
primórdios florais quase indistintos dos foliares (fases A–C), rudimentos de inflorescência em
crescimento (fases D–E), maturação (fase F), polinização (fase F2), senescência dos amentos e início do
desenvolvimento dos frutos (fases G–H). Para cada uma das fases D–G faz-se a distinção entre floração
masculina e feminina acrescentando uma letra, por exemplo Fm2 é a fase de ântese e Ff2 é a fase de
receptividade. Sobretudo a partir da fase D, esta subdivisão permite acompanhar facilmente o processo
de floração em cada árvore [Brás 1999].
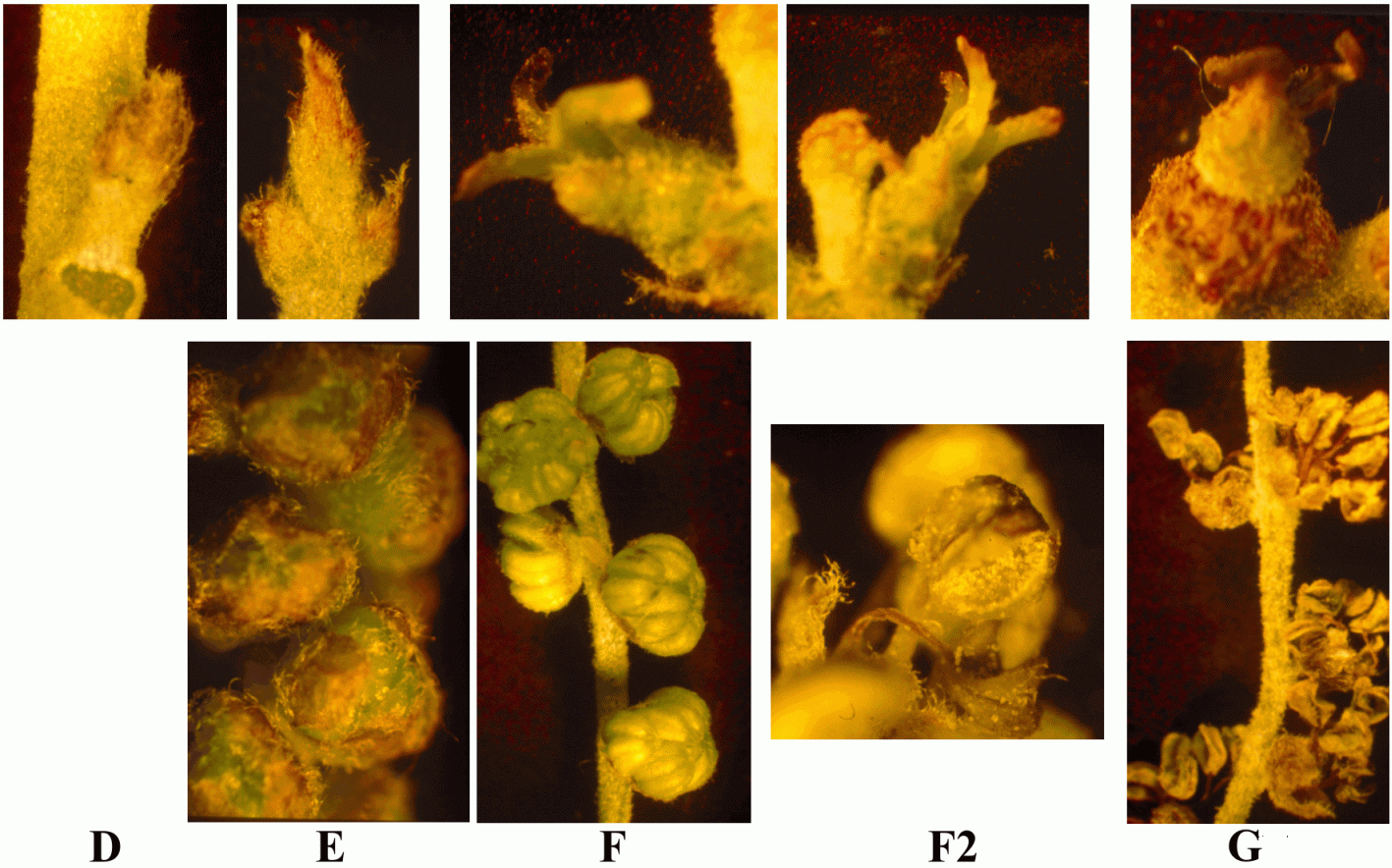 Figura 2.4 — Ilustração dos estádios de desenvolvimento definidos por Varela & Valdivieso
[1996] para sobreiro, com a gentil cedência de M. C. Varela. Na fila superior, flores femininas, na
inferior, amentilhos (excepto na fase F2, pormenor das anteras em ântese).
Figura 2.4 — Ilustração dos estádios de desenvolvimento definidos por Varela & Valdivieso
[1996] para sobreiro, com a gentil cedência de M. C. Varela. Na fila superior, flores femininas, na
inferior, amentilhos (excepto na fase F2, pormenor das anteras em ântese).
Por serem de observação relativamente fácil, as fases de floração masculina são o objecto de observação
utilizado no campo para caracterizar a fenologia do processo em cada indivíduo [Brás 1999, M. C.
Varela, não-publicado], mas também se pode optar por acompanhar a fenologia feminina colhendo ramos
para serem observados em laboratório [Díaz-Fernández et al. 2004]. A variação fenológica da floração
a nível populacional pode assim evidenciar-se como relativamente dispersa no tempo, podendo haver
intervalos de mais de 1 mês entre indivíduos da mesma parcela, apresentando uma repetibilidade elevada,
isto é, árvores de floração por exemplo precoce num determinado ano são-no provavelmente na maior
parte dos anos [M. C. Varela, não-publicado]. Uma consequência desta característica é reduzir-se a
possibilidade do cruzamento entre certas árvores distanciadas fenologicamente, mesmo que próximas
topograficamente.
Apesar da dispersão fenológica, podem alinhar-se os processos de desenvolvimento floral de
diferentes indivíduos usando a ântese como referência [Cecich 1997a], que dura em geral apenas 1
semana ou menos [Williams et al. 2001] e antecede em alguns dias o início da receptividade das flores
femininas na mesma árvore (protandrismo [Vásquez 1998]), receptividade essa — reconhecível pela
abertura dos estigmas e seu aspecto lubrificado [Steinhoff 1997] — que pode durar 2 semanas ou mais
[Ducousso et al. 1993, Williams et al. 2001]. No entanto, observou-se a situação inversa (isto é,
protoginismo) em Q. serrata Thunb. e Q. mongolica var. crispula (Blume) H. Obashi [Kanazashi et al.
1997b], e parece haver exemplos de protoginismo em espécies normalmente protândricas: registaram-se
em Q. suber florações temporãs, em ramos onde as flores femininas já se encontram fecundadas enquanto
as masculinas ainda só desabrochavam [Natividade 1934 pp. 122–123].
A importância do protandrismo será provavelmente muito relativa, pois dentro da mesma árvore
podem encontrar-se ramos em diferentes fases de desenvolvimento, em função não só da exposição ao
Sol (os quadrantes mais expostos tendem a ser mais precoces) mas também da altura, com a parte
superior da copa mais tardia (de tal modo que podem encontrar-se nos ramos mais altos flores Fm2
enquanto nos mais baixos já se encontram em Ff2) [Vásquez 1998]. Além disso, a proporção de flores
dos dois sexos varia entre indivíduos, podendo assim distinguir-se árvores ginomonóicas (essencialmente
com floração feminina), andromonóicas (sobretudo masculina) e andróginas [Elena-Rossellò et al. 1993,
Vásquez 1998]; o facto de verificar-se, em povoamentos de Q. ilex ssp. rotundifolia, que as árvores
ginomonóicas tendem a florir precocemente, e as andromonóicas tardiamente, acaba por resultar num
comportamento, à escala populacional, protogínico [Vásquez 1998].
Geralmente passam vários anos desde a germinação até à maturação reprodutora, mas os
rebentamentos de toiça ou garfos de árvores maduras florescem e frutificam prontamente [Cecich 1997a].
A temperatura afecta sobretudo a floração masculina, atrasando o respectivo desenvolvimento se
for mais baixa que o normal, e antecipando a ântese se for elevada [Cecich 1997a] — a ponto de ocorrer
ainda no Outono ou princípios de Inverno em anos mais quentes, como se observa nalgumas azinheiras
[Brandão 1996]; a produtividade feminina não é afectada a não ser que se dêem extremos térmicos que
destruam as flores [Cecich 1997a].
2) Polinização
A polinização anemófila, isto é, o transporte do pólen pelo vento, é claramente predominante nos
Quercus [Manos et al. 2001], sendo o contributo dos insectos (abelhas, afídeos, formigas e dípteros)
residual [Vásquez 1998]. Sobre a viabilidade do pólen dos Quercus em condições naturais só existe
informação em algumas espécies, nem sempre comparável: em Q. petræa e Q. pubescens prolonga-se
por 25 dias à temperatura ambiente [Bruschi et al. 2000], para Q. gambelii Nutt. e Q. grisea Liebm.
contaram-se mais de 2 semanas sobre gelo, num exsicador [Williams et al. 2001], e mantinha-se ao fim
de 4 semanas em 40% de pólen de Q. ilex ssp. rotundifolia, 48% do de Q. coccifera, 50% do de Q.
faginea, e 57% do de Q. suber [Gómez-Casero et al. 2004]. Mas o pólen de árvores sobrevivendo em
condições ambientais limite, mesmo sendo viável em testes de laboratório, pode não ser inteiramente
funcional, o que pode ter implicações importantes para o hibridismo (hipótese da emasculação ambiental,
cf. secção C3 [Williams et al. 2001]). No mesmo sentido vai a observação dum marcado contraste entre
as estimativas de viabilidade às 48 horas e a correspondente taxa de germinação, que chega a baixar para
¼ daquele valor em Q. suber [Gómez-Casero et al. 2004].
A polinização é afectada por factores ambientais, na medida em que a chuva e mesmo a humidade
relativa reduzem a dispersão do pólen [Cecich 1997a]. Em contrapartida, condições de secura (menos
de 75% de humidade relativa) reduzem a viabilidade e germinabilidade do pólen e o tempo de
receptividade dos estigmas [Vásquez 1998].
Os Quercus são tidos como exemplos de árvores que evitam a autopolinização [Hamrick et al.
1979, Sedgley & Griffin 1989]. O principal contributo do protandrismo pode ser o de reduzir a
possibilidade de autofertilização dentro do mesmo ramo, mas tendo em conta o desfasamento entre as
florações masculinas de ramo para ramo na mesma árvore, e a duração da viabilidade do pólen, existe
oportunidade para autopolinização, especialmente em indivíduos que produzem muito pólen.
Deverão existir factores compensatórios da autopolinização, dos quais se destaca a
autoincompatibilidade, como se verifica em polinizações controladas (cf. secção C) e pela caracterização
de descendências espontâneas com marcadores genéticos altamente polimórficos (cf. secção D1). Essa
autoincompatibilidade deverá resultar dum controlo gametofítico (isto é, sobre os genótipos dos
gametófitos masculinos) do crescimento do tubo polínico [Ducousso et al. 1993]. Contudo, Cecich
[1997b] fez uma interpretação diferente dos padrões de abortamento dos tubos polínicos em Quercus
alba, Q. rubra e Q. velutina Lam., postulando factores ambientais ou um controlo esporofítico.
Na nuvem polínica a que estão expostas as flores receptivas duma determinada árvore poderão
estar largamente representadas árvores vizinhas e fenologicamente síncronas, se as houver, sendo o
restante de origem mais remota. Os progenitores masculinos em localizações remotas, individualmente
menos representados na polinização duma árvore em Ff2, mas em muito maior número do que os
vizinhos também representados, contribuem em princípio com uma grande variabilidade genética. Assim,
pode predizer-se que os Quercus tendem a ser dualmente polinizados: por alguns indivíduos próximos
topograficamente, que tenderão a ser os mesmos ano após ano em função da sua maior ou menor
persistência em coincidirem fenologicamente com a árvore que polinizam, e por uma massa
extremamente diversificada de indivíduos de origens mais ou menos remotas. A primeira componente
pode imprimir uma diferenciação significativa entre as populações de gâmetas masculinos participantes
na formação de cada família. E, dada a longevidade destas espécies (em geral férteis durante várias
dezenas de anos) e a sua prolificidade (não é invulgar a contagem de 1000 sementes descendentes duma
só árvore por ano, e num ano de safra até muito mais), cada árvore terá o potencial de deixar uma
descendência muito numerosa e muito diversificada geneticamente, mas diferenciada da de outras árvores
da mesma população.
Hibridismo
A separação fenológica é a priori uma boa barreira de separação entre espécies, mas dada a grande
variabilidade temporal entre indivíduos nas suas fases de ântese/ receptividade, acaba sempre por poder
haver uma sobreposição entre as épocas de reprodução de 2 espécies simpátricas, e portanto uma fase
em que as nuvens polínicas locais serão mistas. Assim, o isolamento entre espécies deve também residir
em mecanismos actuando após a polinização, seja durante a germinação dos tubos polínicos ou no seu
desenvolvimento através do estilete, na competição entre eles para os óvulos, e ainda na viabilidade dos
embriões ou no vigor vegetativo das plantas germinadas [Bruschi et al. 2000]. Em grande parte
desconhece-se a contribuição relativa destes factores, mas há resultados de experiências de polinização
controlada bastante informativos (revistos na secção C).
É comum assumir-se que uma espécie cuja época de floração é a mais tardia deverá ser a
polinizadora nos eventos de hibridismo, porque o protandrismo favorece nesse sentido [Boavida et al.
2001] (ou a de floração mais precoce, nos casos de protoginismo [Kanazashi et al. 1997b]). Porém, se
se levar em conta a contribuição de proveniências mais remotas para a polinização, e supondo que a
viabilidade desse pólen é suficientemente longa, a questão do sentido preferencial do fluxo genético por
hibridismo não dependerá do protandrismo — mas então torna-se importante incluir o factor viabilidade
nos estudos a serem feitos.
3) Fertilização
Os tubos polínicos desenvolvem-se logo que os grãos de pólen atingem o estigma receptivo, que
se caracteriza pela sua adesividade, atravessando o estilete até à sua base, onde param de crescer entre
poucas semanas até cerca de 1 ano, segundo a espécie tem frutificação anual ou bienal, respectivamente
[Cecich 1997a, Boavida et al. 1999]. Ao retomarem o crescimento, que é coordenado com a
megasporogénese [Cecich 1997a], atingem o ovário com 6 óvulos, dos quais apenas 1 (presumivelmente
o primeiro a ser fertilizado) se desenvolverá até formar a semente [Mogensen 1975, Ducousso et al.
1993, Williams et al. 2001].
Pode haver espécies em que a frutificação é facultativamente anual ou bienal, o que implicaria a
possibilidade de no mesmo ano de frutificação coexistirem sementes resultantes de dois anos sucessivos
de polinização. Esse pode ser o caso do sobreiro, cujo “bastão” (lande relativamente precoce) se presume
ser bienal e ocorre especialmente em regiões mais frias, onde o ciclo vegetativo é mais curto, e em
indivíduos com floração tardia para a espécie (ou em segundo surto de floração), ambos os factores
levando a diferir a fertilização para a Primavera seguinte [Elena-Rossellò et al. 1993, Vásquez 1998,
Bellarosa 2003, Díaz-Fernández et al. 2005]. A ocorrência excepcional de floração feminina no Outono poderá dar lugar a frutos mais precoces, mas normalmente é improdutiva [Vásquez 1998, Díaz-Fernández et al. 2005].
B — Frutificação, dispersão e germinação
1) Flutuações da produção de semente
A produção de semente nos Quercus oscila de ano para ano, ocorrendo frutificações
particularmente abundantes, a que se dá o nome de safras, em anos relativamente afastados entre si. Além
das influências exógenas (precipitação, temperaturas, insectos consumidores das sementes), atribui-se
grande relevância aos ritmos endógenos relacionados com a disponibilidade de reservas metabólicas para
investir na reprodução, sendo a produção de flores femininas condição necessária mas não suficiente para
ocorrer uma safra (o abortamento de flores polinizadas é considerado um processo complementar de
regulação endógena [Vásquez 1998]).
Numa comparação entre Q. alba (frutificação anual), Q. rubra e Q. velutina (ambas bienais),
durante um período de 8 anos, verificou-se que a intensidade de produção era periódica, e que a duração
do período era característica para cada uma dessas espécies [Sork et al. 1993a]: em Q. alba durava 3
anos, no qual a um ano de maior produção se seguiam dois de pouca semente, o primeiro de relativo
“repouso” mesmo a nível de floração, e o segundo de iniciação dum maior número de primórdios florais
donde resultariam no ano seguinte os frutos de novo pico de produção; em Q. rubra o padrão seria
semelhante, mas com um ciclo de 4 anos por causa da frutificação bienal; quanto a Q. velutina, o ciclo
de produção aparente era de 2 anos, diferindo de Q. rubra pelo facto de, num ano de grande produção,
estarem já a iniciar-se os primórdios florais do pico de produção seguinte.
Num estudo com sobreiros em Portugal [M. C. Varela, não publicado], a intensidade de floração,
que se verificou ser bastante diferenciada entre indivíduos, não se correlacionava com a respectiva
intensidade de frutificação, de tal modo que a produtividade individual de cada árvore era imprevisível
na maior parte dos casos. Porém, em termos médios para o conjunto da parcela as duas características
flutuavam quase paralelamente de ano para ano, com uma alternância entre anos de alta e baixa produção
de semente com período de 2 anos, embora fosse patente alguma perturbação desta periodicidade por
condições de secura fora do normal.
2) Dispersão e selecção pós-germinação
Entre a germinação duma semente de Quercus e atingir-se a fase adulta têm de conjugar-se
condições edáficas e climáticas propícias, suficiente exposição à luz solar e sobrevivência aos herbívoros
(factores extrínsecos), e capacidade de competir para esses recursos com outras plantas, sejam da mesma
espécie ou doutras (factores intrínsecos). Daí que, nas descendências produzidas, se tenha de contar com
elevadas taxas de eliminação.
O valor nutritivo das sementes dá-lhes uma grande importância ecológica para diversos animais,
que com a sua actividade (principalmente aves e mamíferos) chegam a fazê-las desaparecer do local de
queda apenas no espaço de 1 dia [Siscart et al. 1999]. Essa actividade contribui grandemente, pela
dispersão que opera nas sementes, para uma relativa homogenização dos genótipos nas populações. Mas
é na imprevisibilidade da ocorrência duma safra que há uma melhor oportunidade para a regeneração
natural, por criarem-se excedentes de semente em relação à acção dos herbívoros, interpretação que é
reforçada pela evidência de sincronização intra-específica, quer em espécies bienais quer nas anuais
[Liebold et al. 2004].
Após a germinação coloca-se o problema do ensombramento para as plantas em desenvolvimento,
limitando-o mais ou menos dependendo da densidade dos povoamentos e da tolerância da espécie: assim,
a regeneração efectiva dentro de uma população natural densa, dominada por árvores adultas, só se dá
esporadicamente, em pontos deixados livres pelo desaparecimento dum adulto [Dow & Ashley 1997,
Cottrell et al. 2003]; no entanto, a adaptação de certos Quercus ao ensombramento é um factor de
competição com espécies pioneiras [Petit et al. 2003]. Uma folhagem espinhosa na fase jovem, como é
o caso da azinheira, pode contribuir para reduzir o impacto dos herbívoros.
Os factores intrínsecos relacionam-se com o valor genotípico de cada indivíduo para atingir o porte
adulto, nas condições do local onde germina, o que contribui substancialmente para a sua adaptabilidade
diferencial (fitness) [Falconer & MacKay 1996]. As diferenças de adaptabilidade expressam-se a vários
níveis: entre indivíduos da mesma população [Müller-Starck et al. 1993], com a observação de variações
fenotípicas importantes dentro de pequenas áreas, isto é, em condições edafoclimáticas relativamente
homogéneas, ou nas descendências de cada indivíduo, havendo ainda que contar com a eventualidade
do hibridismo ter valor adaptativo (cf. parte I secção B). Mais do que pelas variações morfológicas que,
podendo assentar na plasticidade fenotípica frequente nos Quercus, não terá grande significado para o
fitness, é sobretudo em aspectos fisiológicos que se devem procurar padrões de adaptabilidade [Kriebel
1993, Sork et al. 1993b]. Mesmo na criação em viveiro, em princípio sob condições uniformes e
controladas [Varela et al. 2003a], se manifestam diferenças de vigor entre indivíduos que são sugestivas
de diferenças que se expressam no desenvolvimento das plantas após a germinação, sendo de presumir
que tais diferenças de vigor em fases precoces tenham relevância para a adaptação local em condições
naturais (por outras palavras, na manutenção do fitness a nível populacional).
C — Experiências de polinização controlada
Conhecem-se alguns estudos experimentais de polinização controlada nos Quercus que têm
permitido comparar o sucesso de diferentes modelos de cruzamento e nalguns casos caracterizar os
processos que decorrem desde a germinação do tubo polínico até ao desenvolvimento do fruto.
Evidentemente, esta abordagem tem as suas limitações por envolver manipulações experimentais que em
maior ou menor grau se afastam da polinização natural, mas tem a seu favor o aprofundamento que
permite e a corroboração parcial pelas observações com marcadores genéticos (cf. secção D).
1) O processo de desenvolvimento desde a polinização até à maturação do embrião
Em primeiro lugar, há que sublinhar o facto de todo o processo se caracterizar por taxas de
abortamento muito altas, desde logo nas flores femininas polinizadas e continuando nos frutos em
desenvolvimento, taxas essas que se pode considerar não serem uma consequência trivial das
manipulações (emasculação, isolamento dos ramos, colheitas). Assim, na natureza as potencialmente
abundantes produções de semente de cada ciclo reprodutor representam apenas uma ínfima parte dos
tubos polínicos germinados [Yacine & Bouras 1997, Cecich 1997b, Kanazashi & Kanazashi 1997,
Boavida et al. 2001], o que é de especial relevância para qualquer discussão que se possa fazer, por
exemplo no contexto da hibridação, sobre a relação entre a origem do pólen que atinge as flores
receptivas de uma árvore e as características da descendência dessa árvore. Contudo, e como se verá,
nalguns casos demonstrou-se que as taxas de abortamento podem variar conforme a origem dos
gametófitos masculinos.
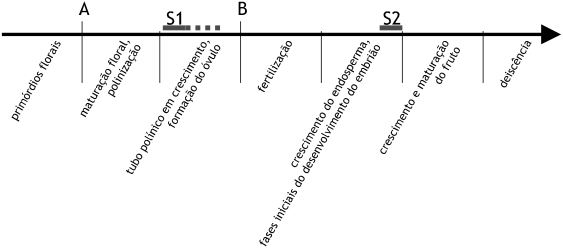 Figura 2.5 — As fases da reprodução sexuada dos Quercus, evidenciando duas pausas (A,
primórdios florais imaturos no inverno anterior à polinização; B, tubos polínicos na base do estilete,
enquanto não se conclui a megasporogénese, que nas espécies de frutificação bienal abrange um
segundo inverno) e dois períodos de maior incidência de abortamento floral (S1) e dos frutos (S2).
A extensão das fases não é ilustrada em proporção à escala de tempo. Compilado de várias fontes
[Cecich 1997a,b, Williams et al. 2001, Kanazashi & Kanazashi 1997, Yacine & Bouras 1997, Boavida
et al. 1999, Sork et al. 1999].
Figura 2.5 — As fases da reprodução sexuada dos Quercus, evidenciando duas pausas (A,
primórdios florais imaturos no inverno anterior à polinização; B, tubos polínicos na base do estilete,
enquanto não se conclui a megasporogénese, que nas espécies de frutificação bienal abrange um
segundo inverno) e dois períodos de maior incidência de abortamento floral (S1) e dos frutos (S2).
A extensão das fases não é ilustrada em proporção à escala de tempo. Compilado de várias fontes
[Cecich 1997a,b, Williams et al. 2001, Kanazashi & Kanazashi 1997, Yacine & Bouras 1997, Boavida
et al. 1999, Sork et al. 1999].
Na figura 2.5 representa-se esquematicamente a sequência de todo o processo. Nele se assinalam
duas pausas: durante a passagem do inverno antes da polinização (A), e durante a espera dos tubos
polínicos para que se complete o desenvolvimento do gametófito feminino (B) — ambas parecem não
estar associadas a qualquer forma de abortamento das flores ou dos frutos. Os processos que levam a
grande parte do abortamento floral correspondem antes a fases activas de crescimento, uma delas pré-zigótica (S1) que acompanha o desenvolvimento dos tubos polínicos, especialmente nas primeiras fases,
e outra pós-zigótica (S2) associada à diferenciação do embrião.
2) Polinização self, conspecífica ou heterospecífica
As experiências de polinização controlada incluem em geral a comparação entre diferentes tipos
de polinização. Assim, para além da polinização self (pólen da própria árvore) consideram-se a
polinização conspecífica (pólen de indivíduos da mesma espécie, representados individualmente ou em
misturas de pólens) e heterospecífica (com pólen de indivíduos de outra espécie). Note-se que a
polinização livre (natural) é em teoria uma mistura dos três tipos, mas surpreendentemente isso não
parece ser determinante para o desenho experimental destes estudos.
Do ponto de vista da produção de frutos, a eficiência dos diferentes tipos de polinização controlada
tende a ser maior com a polinização conspecífica do que com a heterospecífica, e mínima com
polinização self (Q. petræa e Q. robur [Steinhoff 1997], Q. gambelii e Q. grisea [Williams et al. 2001],
Q. suber e Q. ilex ssp. rotundifolia [Boavida et al. 2001]).
Estas comparações só são válidas do ponto de vista da espécie que é polinizada, pois para as
mesmas condições experimentais verificam-se grandes diferenças entre espécies. Aliás, o sucesso
relativo das polinizações conspecífica e heterospecífica pode ser afectado por condições ambientais
“emasculadoras” [Williams et al. 2001], ou não ser mensurável em espécies refractárias à polinização
controlada (caso de Q. suber [Boavida et al. 2001]). Além disso, as incompatibilidades entre indivíduos
da mesma espécie (Q. ilex ssp. rotundifolia [Yacine & Bouras 1997]) ou de espécies próximas (Q. petræa
e Q. robur [Kleinschmit 1993], Q. serrata com pólen de Q. mongolica var. crispula [Kanazashi et al.
1997b]) podem resultar em improdutividades comparáveis às das polinizações self, ou até piores.
3) Processos de eliminação
Fases S1 e S2
Em todos os tipos de polinização controlada é usual observar o abortamento de flores femininas
nos primeiros dias após a aplicação do pólen, identificada com a fase S1 da figura 2.5 [Kanazashi &
Kanazashi 1997, Yacine & Bouras 1997, Boavida et al. 2001], e distinta do abortamento observado em
flores não-polinizadas e autopolinizadas (caso de Q. serrata [Kanazashi & Kanazashi 1997]), que ocorre
mais tarde enquanto noutras flores se desenvolve o endosperma. A maior proporção de abortamento das
flores ocorre na fase S1 [Kanazashi & Kanazashi 1997, Yacine & Bouras 1997, Boavida et al. 2001],
podendo ser desencadeada quer pela interacção entre pólen e estigma [Yacine & Bouras 1997], quer pelo
bloqueamento dos tubos polínicos no estigma e estilete, presumivelmente por interacções com a flor
feminina e/ou factores ambientais [Cecich 1997b, Boavida et al. 1999]. Pelo menos num caso não houve
diferenças entre a polinização conspecífica e a heterospecífica, em termos de eliminação pré-fertilização
[Williams et al. 2001].
O abortamento de frutos na fase S2 pode variar com o tipo de polinização, sendo relativamente
mais elevado na heterospecífica em comparação com a conspecífica [Kanazashi et al. 1997b, Boavida
et al. 2001, Williams et al. 2001]. No caso das polinizações self, julga-se que a expressão de recessivos
letais compromete o desenvolvimento dos frutos, seja em termos de abortamento ou de peso final
[Steinhoff 1997, Williams et al. 2001], julgando-se ser essa a razão para a fraca taxa de germinação das
sementes resultantes [Steinhoff 1997, Yacine & Bouras 1997].
Kanazashi et al. [1997b], ao aplicarem em flores de Q. serrata uma mistura de pólen conspecífico
e heterospecífico, de parceiros previamente verificados como compatíveis, obtiveram uma proporção
muito baixa de sementes híbridas (identificadas através de isoenzimas discriminantes), sugestiva duma
maior eficiência da linhagem homospecífica — contudo, não foi determinado se o contraste se deu ao
nível da germinação no estigma, do desenvolvimento do tubo polínico, da fertilização ou da
diferenciação do embrião.
Pólen incompatível
O pólen self é o paradigma da incompatibilidade entre dois parceiros. No estudo com azinheira
[Yacine & Bouras 1997] foi demonstrado, em polinizações envolvendo pólen self (misturado com o
pólen doutro indivíduo ou em polinização livre) que ele tem um papel indirecto no abortamento floral,
ao que parece através da sua lenta germinação no estigma; o número presumivelmente elevado de
gametófitos self presentes em polinização livre terá sido a provável causa para o aparente
“cancelamento” do processo, sugerido pela correlação positiva entre o abortamento floral e o número de
tubos polínicos atravessando o estigma e o segmento superior do estilete. Nesse mesmo estudo, a
incompatibilidade entre indivíduos parecia expressar-se através da correlação entre o número de tubos
polínicos a atingirem o ovário (antes do ponto B na figura 2.5) e o abortamento dos frutos, sugestivo de
que um excesso de tubos polínicos nessa região do pistilo resulta também num “cancelamento”.
De notar que as variações individuais na compatibilidade com outros parceiros se expressam
também na proporção de flores e frutos abortados em cada árvore [Kanazashi & Kanazashi 1997, Yacine
& Bouras 1997].
A outro nível, a incompatibilidade entre parceiros manifesta-se por uma frequente “assimetria”
do fluxo genético entre espécies. As polinizações heterospecíficas são geralmente melhor sucedidas num
sentido que no outro, isto é, quando o parceiro feminino é duma das espécies — Q. robur com pólen de
Q. petræa [Kleinschmit 1993, Steinhoff 1997], Q. serrata com pólen de Q. mongolica var. crispula
[Kanazashi et al. 1997b], Q. gambelii com pólen de Q. grisea [Williams et al. 2001], Q. ilex com pólen
de Q. suber [Boavida et al. 2001]. Embora falte o teste crítico com misturas de pólens, poderia deduzir-se uma direccionalidade preferencial do hibridismo em cada par de espécies. Uma predição desta
direccionalidade preferencial é o predomínio nos híbridos de DNA citoplásmico da espécie mais
receptiva [Williams et al. 2001] (os exemplos conhecidos são revistos na secção D2 e também na parte
III, secção D2); como discutido na secção A2, a diferenciação temporal entre espécies, em termos de
época de floração, deverá ter um papel muito secundário na determinação dessa direccionalidade.
Emasculação ambiental
Num estudo com duas espécies da secção Albæ, Q. gambelii e Q. grisea [Williams et al. 2001],
em dois locais diferindo na taxa espontânea de hibridismo, sugeriu-se que as diferenças ecológicas entre
os dois locais tinham como consequência previsível o relaxamento das barreiras interspecíficas; neste
caso, o local com hibridismo era aquele onde Q. gambelii se encontrava no seu limite ecológico, e em
particular era o desempenho do seu pólen que se ressentia dessas condições-limite (em cruzamentos
conspecíficos, independentemente do número de grãos de pólen aplicados), produzindo menos frutos do
que no local onde não havia hibridismo. Nas ditas condições-limite, os indivíduos de Q. gambelii, que
por acréscimo tinham pouca floração masculina embora continuassem normalmente produtivos em
termos de floração feminina, encontravam-se como que isolados entre si para a reprodução sexuada,
deste modo facilitando-se a produção de descendências híbridas por “submersão” com o pólen doutras
espécies compatíveis, neste caso Q. grisea. Esta hipótese de “emasculação ambiental” [Williams et al.
2001] parece explicar correctamente as observações do estudo a que se refere, e pode provar-se um
poderoso auxiliar na previsão de hibridismo noutros pares de espécies, embora por enquanto não seja
consensual [Petit et al. 2003], apesar do rigor posto no seu desenho experimental.
É aliás notável a analogia desta hipótese com outra, de acentuado hibridismo nos refúgios durante
a última glaciação, resultando cada árvore encontrar-se também quase isolada em relação a outras da
mesma espécie e em condições ambientais extremas [Kashani & Dodd 2002] (cf secção D2, “DNA
citoplásmico”).
4) Síntese
Em resumo, as observações em diversas espécies de Quercus não parecem contradizer-se entre si,
antes permitindo traçar um conjunto de caracteres gerais relevantes para o conhecimento da biologia da
reprodução neste grupo:
– As plântulas que emergem das sementes derivam duma amostra ínfima do pólen que atinge as
árvores progenitoras, em resultado da selecção a que estão sujeitos tubos polínicos e embriões em
desenvolvimento (fases S1 e S2 da figura 2.5), a que se acrescenta a sua destruição pelos insectos;
– A intensidade da selecção até à maturação das sementes varia segundo factores de
compatibilidade com a planta materna e/ou competição entre tubos polínicos, sendo a rejeição de pólen
self um exemplo constante de forte selecção negativa, a que se acrescenta a tendência das sementes
produzidas deste pólen terem menor taxa de germinação;
– Existe uma grande variação intra-específica, expressa em diversos graus de incompatibilidade
entre indivíduos, nos padrões de eliminação que decorrem entre a polinização e a fertilização;
– Excepto em condições-limite (cf. hipótese da “emasculação ambiental”), o sucesso relativo do
pólen heterospecífico é bastante inferior ao do pólen conspecífico, embora tenda a ser superior ao do
pólen self pelo menos entre espécies que usualmente hibridam entre si.
Em conclusão, o hibridismo entre Quercus na natureza tende a ser improvável, mas a produção
de sementes durante a prolongada vida reprodutora dum Quercus é suficientemente abundante para a
emergência de combinações improváveis, por isso conferindo-lhe algum significado, que se pode
acentuar devido a factores adicionais, por exemplo ambientais, que as favoreçam.
D — Parâmetros genéticos
A contribuição de várias classes de marcadores genéticos, com recurso a tratamentos estatísticos
diversos, tem sido particularmente relevante para o esclarecimento dos processos reprodutores intra-específicos em Quercus, mas no que respeita aos envolvidos na hibridação já não se pode dizer o mesmo.
Por isso serão analisados separadamente.
1) Fluxos genéticos intra-específicos
Duas estratégias para a caracterização dos fluxos polínicos
Têm-se utilizado essencialmente duas estratégias para análise dos processos reprodutores com
marcadores genéticos [Smouse & Sork 2004]. Apesar de haver necessidade de aperfeiçoar a base teórica
de qualquer destas estratégias [Burczyk & Chybicki 2004, Walter & Epperson 2004, Austerlitz et al.
2004, Dutech et al. 2005], é inegável que a compreensão da biologia da reprodução dos Quercus já tem
beneficiado de progressos significativos com os marcadores genéticos.
A primeira coloca a ênfase na identificação dos polinizadores, e envolve a caracterização
genotípica de tantos indivíduos quanto possível de modo a permitir construir curvas de distribuição das
origens do pólen em função da sua distância às árvores polinizadas, e a calcular taxas de selfing, de
imigração e (cf. secção 2) de hibridação.
A segunda estratégia coloca a ênfase na especificidade da população polínica utilizada por cada
árvore e requer apenas a caracterização genotípica das descendências e respectivas mães, o que, usando
marcadores suficientemente informativos, permite determinar com precisão o genótipo de cada grão de
pólen; menos exigente que a primeira na dimensão de amostragem da família, tem de abranger um grande
número de famílias para ser efectiva [Smouse et al. 2001, Austerlitz & Smouse 2001]. Dela se pode
calcular a estatística ΦFT [Smouse et al. 2001], definida como a probabilidade de dois grãos de pólen
representados numa família virem do mesmo indivíduo, sendo dependente de vários parâmetros, entre
os quais a dispersão média do pólen a partir de cada árvore (δ) e a forma da distribuição do pólen no
espaço bidimensional [Austerlitz & Smouse 2002]; o inverso de ΦFT é proporcional ao número efectivo
de polinizadores por família, Nep, parâmetro que, levando em conta a densidade dos potenciais
polinizadores por unidade de área, permite determinar δ [Smouse & Sork 2004]. Contudo, subsistem
diversas incógnitas sobre o valor efectivo dessa densidade, devido às irregularidades existentes (nem
todos os adultos se reproduzem em todos os anos, nem com igual intensidade, nem simultaneamente
[Austerlitz & Smouse 2001, Smouse & Sork 2004]), por isso, se por um lado δ é um padrão de
comparação importante [Smouse & Sork 2004], a assimetria da distribuição de polinizadores em função
da distância e sobretudo o desconhecimento sobre o respectivo modelo matemático [Austerlitz et al.
2004] torna problemática a sua estimação para cada caso.
O desenho de amostragem apropriado para a segunda estratégia é-o também para os cálculos de
percentagens de selfing e de consanguinidade biparental (resultante da correlação genética positiva entre
parceiros de cruzamento) [Ritland 1990].
Os polinizadores
Os micro-satélites nucleares (loci nSSR) têm sido os principais protagonistas desta abordagem:
altamente polimórficos e a maior parte não ligados cromossomicamente, nem precisam de ser muitos para
a identificação de cada adulto dum povoamento, sem ambiguidades. Segundo os estudos, demonstrou-se
maior ou menor tendência dos polinizadores mais próximos serem os individualmente mais representados
na amostragem (figura 2.6), donde se conclui que o número efectivo de progenitores polínicos por
família pode ser bastante limitado [Dow & Ashley 1997, Streiff et al. 1999]. Apesar disso, geralmente
a maior parte das descendências derivam de pólen de origem remota (de polinizadores diferentes dos
identificados nas parcelas de estudo): já corrigido o “fluxo polínico críptico”, que leva em conta a
possibilidade de haver pólen externo idêntico ao do produzido por estes progenitores, calculou-se 62%
de pólen remoto numa parcela de Q. macrocarpa [Dow & Ashley 1997], 65% num povoamento misto
de Q. robur e Q. petræa [Streiff et al. 1999], 69% e 64% noutro de Q. pyrenaica e Q. petræa
 , o que
pode surpreender na população de Q. petræa, por estar bastante afastada de povoamentos da mesma
espécie [Valbuena-Carabaña et al. 2005], e só em fragmentos populacionais de Q. humboldtii Bonpl.
relativamente isolados é que se cifrou pelos 32% [Fernández-M. & Sork 2005].
, o que
pode surpreender na população de Q. petræa, por estar bastante afastada de povoamentos da mesma
espécie [Valbuena-Carabaña et al. 2005], e só em fragmentos populacionais de Q. humboldtii Bonpl.
relativamente isolados é que se cifrou pelos 32% [Fernández-M. & Sork 2005].
 Figura 2.6 — Distribuição teórica dos polinizadores de árvores de Q. petræa em termos de distância num
espaço bidimensional (intervalos de 1 metro), segundo um modelo exponencial de expoente negativo (distribuição
leptocúrtica em comparação com a gaussiana). As percentagens são para as sucessivas coroas de 20 metros, e o
conjunto soma 31,8% até aos 200 metros. A curva para Q. robur foi quase idêntica (adaptado de Streiff et al. [1999]).
Figura 2.6 — Distribuição teórica dos polinizadores de árvores de Q. petræa em termos de distância num
espaço bidimensional (intervalos de 1 metro), segundo um modelo exponencial de expoente negativo (distribuição
leptocúrtica em comparação com a gaussiana). As percentagens são para as sucessivas coroas de 20 metros, e o
conjunto soma 31,8% até aos 200 metros. A curva para Q. robur foi quase idêntica (adaptado de Streiff et al. [1999]).
Seria necessário realizar amostragens cobrindo áreas muito grandes para determinar com algum
rigor a forma da curva de distribuição dos potenciais polinizadores em função do espaço, o que se pode
tornar impraticável por várias razões. Esta questão tem implicações sobretudo na estimação correcta de
parâmetros como a densidade dos polinizadores mais próximos e a distância média de polinização
[Dutech et al. 2005], e verificou-se por modelação que a função exponencial da figura 2.6 [Streiff et al.
1999] não será a melhor para as observações de várias espécies, incluindo Q. lobata Née [Austerlitz et
al. 2004].
Apenas um estudo quantificou, num total de 959 descendentes de Q. robur e Q. petræa, 15 de
pólen self, isto é, cerca de 1,6% [Streiff et al. 1999].
As famílias
Ainda antes de ter-se desenvolvido a estatística ΦFT, já se tinha revelado com loci nSSR a
heterogeneidade genética entre as diferentes famílias produzidas numa parcela de cerca de 5 hectares
com igual representação de Q. robur e Q. petræa [Streiff et al. 1999], reflectindo a heterogeneidade
entre o pólen que fertilizou as diferentes árvores, isto apesar de globalmente a nuvem polínica presumir-se homogénea para toda a população, o que após repetidas demonstrações daquela heterogeneidade foi
apelidado de “mito estatístico” [Smouse et al. 2001, Smouse & Sork 2004].
Tendo em conta resultados como o da figura 2.6, a provável causa da diferenciação do património
genético (polínico) disponível para cada árvore reflecte a importância dos polinizadores mais próximos.
De facto, a teoria baseada no cálculo de ΦFT sugere que o pólen recebido por cada árvore deriva dum
número limitado de “progenitores efectivos” [Smouse & Sork 2004], o que é inesperado para espécies
de polinização anemófila mas que se entende perfeitamente em termos de valores efectivos; e que a
distância média de dispersão polínica é, salvaguardando as ressalvas enunciadas acima ao cálculo de δ,
de apenas umas dezenas de metros.
Numa abordagem muito diferente, mas essencialmente convergente, a análise de loci nSSR ligados
no mesmo cromossoma permitiu, a partir do número de haplótipos de pólen que fecundou cada árvore
mãe, determinar correlações genéticas significativas entre gâmetas masculinos que fecundaram cada
árvore em Q. robur [Lexer et al. 2000], levando à estimativa de algumas dezenas de progenitores reais.
Em Q. humboldtii, usando esta estratégia de amostragem, determinou-se que a taxa de selfing
atinge 3% [Fernández-M. & Sork 2005], podendo ir até 6% noutras espécies [Smouse & Sork 2004].
No contexto do controlo de contaminantes nos lotes comerciais de semente de Q. robur, e tirando
partido do elevado polimorfismo dos loci nSSR e de variados tratamentos estatísticos, demonstrou-se
que o conhecimento a priori do genótipo das mães pode nem sequer ser necessário [Lexer et al. 1999];
depois de removidos os contaminantes, verificaram uma elevada diferenciação genética entre famílias,
e algum grau de consanguinidade dentro de famílias, atribuindo-se esta última à componente biparental
de consanguinidade.
Heterogeneidade espacial
Os dados disponíveis apontam para uma limitada dispersão via semente, geralmente não
ultrapassando a centena de metros, sem embargo de demonstrar-se imigração [Dow & Ashley 1997,
Grivet et al. 2005, Valbuena-Carabaña et al. 2005]. Associando a este factor a tendência para
diferenciação entre famílias documentada acima, esperar-se-ia uma distribuição espacial dos genótipos
marcadamente não-aleatória.
A identificação dos genótipos dentro da população (primeira estratégia) permite obter medidas da
tendência de agrupamento no espaço entre indivíduos aparentados geneticamente, nomeadamente a
autocorrelação espacial, que numa população panmíctica não devem afastar-se do valor 0 em todas as
classes de distância. Em geral é essa a situação que se encontra [Streiff et al. 1998], mas as
circunstâncias que produzem valores significativamente diferentes são sugestivas: por um lado, um
tamanho de amostragem adequado, diversificação do tratamento dos dados [Cottrell et al. 2003],
refinamentos utilizando coeficientes de parentesco entre adultos, e diversas correcções, como para a
orientação dominante dos ventos [Dutech et al. 2005]; por outro, as características da amostra, seja pela
existência de limites topográficos à migração via semente [Chung et al. 2002, Cottrell et al. 2003] ou
por tratar-se de indivíduos jovens [Müller-Starck et al. 1993, Dow & Ashley 1997, Chung et al. 2002,
Cottrell et al. 2003, Jensen et al. 2003]. A utilização de marcadores nucleares ligados [Lexer et al. 2000]
poderia em princípio tornar ainda mais evidentes os padrões espaciais dentro das populações, mas tem
tido pouca aplicação.
Assim, para além da importância de aperfeiçoamento dos esquemas de amostragem e do
tratamento dos dados [Vekemans & Hardy 2004], verifica-se que a aparente aleatoriedade de distribuição
dos genótipos das populações adultas de Quercus não é uma propriedade da reprodução sexuada em si
mesma — que pelo contrário tende a produzir uma diferenciação genotípica no espaço — mas sim a
resultante de processos a posteriori, provavelmente de eliminação por competição intra-específica
[Chung et al. 2002, Jensen et al. 2003], sendo que alguns autores vão ao ponto de postularem o
envolvimento de selecção contra os indivíduos consanguíneos [Streiff et al. 1998, Fernández-M. & Sork
2005].
Note-se que a reduzida dispersão de sementes observada à escala duma população e num número
limitado de gerações não exclui que ela possa alcançar grandes distâncias. Só assim se compreende a
migração dos Quercus através de centenas de quilómetros de mar, evidente pela presença das duas
subespécies de Q. ilex nas Baleares e da subespécie autónima na Tunísia [Rothmaler 1941], entre tantos
exemplos que se podem citar.
2) Hibridismo
Caracterização dos híbridos
Pela literatura botânica, parece claro que a identificação duma forma como sendo híbrida (entenda-se aqui como tendo progenitores directos indivíduos de duas espécies “boas”) passa por uma série de
critérios bem estabelecidos [Coutinho 1888, Natividade 1936, Wilson 1992, Rushton 1993]: apresentação
de caracteres morfológicos intermédios entre os das duas espécies, assim como os de uma e de outra no
mesmo indivíduo, ocorrência em zonas de simpatria dessas duas espécies, e produção por reprodução
sexuada de descendências segregando caracteres dessas espécies ausentes no híbrido.
No entanto, os marcadores genéticos têm sido pouco eficazes na resolução de problemas
associados à definição do estatuto híbrido de certos Quercus. A maneira mais fácil de definir
geneticamente um híbrido (F1) entre duas espécies é ao nível de loci discriminantes, que sejam
monomórficos em cada uma dessas espécies, pois deverá ser heterozigótico nesses loci, apresentando
como alelos os que são representativos de cada uma (codominância); mas com o género Quercus, na
prática, o único exemplo desta definição é o de Q. × morisii, em loci isoenzimáticos [Oliveira et al.
2003, e presente trabalho] e nos segmentos ITS (internal transcribed spacers, pertencentes à região
média ITS1–5,8S–ITS2 dos loci rDNA [Bellarosa et al. 2005]).
O estudo dos híbridos entre Q. kelloggii Newb. e Q. wizlizenii var. frutescens Engelm. (Q. ×
moreha Kell.) baseou-se em alelos de 6 loci isoenzimáticos, onde os alelos só presentes numa das
espécies, quando ocorriam nos híbridos, permitiam excluir uma ou outra espécie e, por nunca estarem
em homozigose, sugeriam estes serem F1 (um método estatístico de máxima verosimilhança, não
explicitado, concordou com essa interpretação); o facto de usarem apenas 27 indivíduos de cada espécie
para definirem o elenco de variação poderia ser considerado insuficiente, e os desvios entre as
frequências alélicas nos 13 híbridos e os valores esperados intermédios ao das espécies parecem indicá-lo, mas estes autores até consideraram o caso destes híbridos, em comparação com os doutros géneros
analisados no mesmo estudo, relativamente simples por só serem F1s [Nason et al. 1992].
O nome Q. crenata Lam. é considerado um sinónimo de Q. × hispanica [Govaerts & Frodin 1998],
também atribuído a Lamarck (figura 2.3), reflectindo a ambiguidade de concepções sobre o que se tem
pensado ser um mesmo táxone com origem no hibridismo entre Q. suber e Q. cerris. Como Q. crenata,
tratar-se-ia duma hibri-espécie (cf. parte I secção B), isto é, a partir dos híbridos originais teria segregado
uma forma recombinante bem delimitada morfologicamente e “intermédia” entre as duas espécies que
lhe deram origem; como Q. × hispanica, seria simplesmente o híbrido F1 dessas duas espécies. A
morfologia sugere ambas as interpretações para diferentes proveniências [Cristofolini & Crema 2005]:
hibri-espécie quando fora da distribuição geográfica de Q. suber (norte da Itália e regiões próximas, na
Eslovénia e na Croácia), e híbrido F1 na Itália peninsular e Sicília, onde também ocorre Q. suber,
notando-se uma maior variabilidade neste segundo grupo do que no primeiro, talvez um sinal de
instabilidade do desenvolvimento característica de híbridos. O estudo dos ITSs do rDNA dum indivíduo
do sul de Itália foi inconclusivo, apesar de existir uma deleção de 7 pares de bases (bp) partilhada apenas
com Q. suber cuja heterozigose no híbrido, aparentemente, não foi verificada [Bellarosa et al. 2005].
Segundo Cristofolini & Crema [2005], só se conhecem indivíduos mais ou menos isolados (menos de
duas centenas no total da sua distribuição), e sabendo-se que Q. suber já foi cultivado nas regiões
nortenhas onde actualmente não está presente, assim como pela ausência de regeneração junto dos Q ×
hispanica, a hipótese de hibri-espécie postulada pelos dois grupos de autores parece improvável. As
dificuldades de Bellarosa et al. [2005] podem ser atribuídas a limitações dos segmentos ITS, face à
proximidade filogenética entre as espécies parentais, à variação intra-específica nestas e ao reduzido
número de indivíduos analisados.
Recentemente, Q. afares Pomel (secção Cerris, que forma os híbridos Q. × kabilica com Q. suber,
fig. 2.3), foi interpretada como hibri-espécie derivada do cruzamento entre Q. suber e Q. canariensis
[Mir et al. 2006]. A existência de vários alelos discriminantes em relação a Q. suber, que não é habitual
entre táxones da mesma subsecção, constitui um forte argumento a favor desta interpretação, a par de
se conhecerem híbridos F1 entre as duas espécies consideradas progenitoras (figura 2.3 [Vásquez 1998]),
mas com base nos argumentos ecológicos utilizados teria de assumir-se que a linhagem iniciada nos
híbridos originais se manteve isolada das espécies que supostamente lhe deram origem. Neste estudo é
patente uma interessante demonstração da capacidade dos marcadores genéticos e estatísticas utilizados
de reflectirem as relações filogenéticas entre os 3 táxones, com Q. afares a agrupar-se mais próximo de
Q. suber.
Outras tentativas de demonstrar um estatuto híbrido com marcadores genéticos não foram bem
sucedidas [Rushton 1993, Kremer & Petit 1993, Craft et al. 2002, Scotti-Saintagne et al. 2004, Kelleher
et al. 2005]. Usando “Análise de Diferenças Representacional” para detectar à escala genómica loci
discriminantes entre Q. robur e Q. suber (duas espécies que aparentemente não hibridam, fig. 2.3),
apenas se detectaram sequências repetitivas (retroposões) que, infelizmente, não permitiriam discriminar
Q. robur de Q. petræa [Zoldos et al. 2001].
Introgressão
A interpretação de introgressões não é menos problemática. Mesmo ao nível da morfologia (o
padrão usado pelos taxonomistas) surgem ambiguidades, em grande parte atribuíveis ao polimorfismo
ao nível das folhas mas também à análise estatística efectuada. Assim, verifica-se que o uso de
populações de referência para a construção de funções discriminantes (e outras estatísticas) tende a
empolar a proporção de indivíduos intermédios, ou porque essas populações não são representativas
[Jensen et al. 2003], ou a moda duma espécie não se localiza no extremo do espectro de variação
[Kelleher et al. 2004], ou simplesmente porque a classificação é mais eficiente com outras estratégias
de tratamento dos dados, seja por maximização da variância explicada [Dupouey & Badeau 1993] ou por
distâncias genéticas entre indivíduos [González-Rodríguez & Oyama 2005].
A situação pode ser bastante complexa em casos como o dos híbridos designados Q. subpyrenaica
(entre Q. faginea e Q. pubescens, donde o nome correcto seria Q. × allorgeana, figura 2.3) [Himrane
et al. 2004]. Neles, tanto a morfologia (caracteres foliares e crescimento do tronco) como a fisiologia
(caracteres hidráulicos) revelaram uma variação transcendendo os limites definidos entre as duas
espécies, levando a considerar afinidades em termos fisiológicos com as duas espécies consideradas e
ainda com Q. robur, talvez reflectindo, no contexto geográfico dos pré-Pirinéus em Espanha, uma grex
destas 3 espécies e sob selecção disruptiva.
No caso de Q. robur e Q. petræa [Kremer et al. 2002] concluiu-se que os caracteres foliares não
permitem em si uma resolução completa entre as espécies, porém sem darem evidência dum terceiro
grupo com fenótipos intermédios, que deveria existir caso o hibridismo neste par de espécies fosse
frequente como tende a assumir-se muitas vezes (note-se que, por causa da persistência de efeitos
maternos incidindo nestes caracteres em plantas jovens, só se deve esperar um fenótipo intermédio em
indivíduos adultos). Não é pacífico interpretar-se como sendo casos de introgressão os indivíduos
estatisticamente intermédios, face à ambiguidade dos índices de hibridismo [Wilson 1992] e à
bimodalidade observada nesse estudo. Nomeadamente, os critérios baseados apenas em folhas acabam
por ser irrelevantes, em parte por não haver um limite objectivo em relação à variação intra-específica
normal, mas de modo muito crítico pelo facto do mosaicismo de caracteres morfológicos das duas
espécies, já presente nos híbridos F1, ser imprevisível nas descendências destes [Kremer et al. 2002,
Kelleher et al. 2004].
Há que referir o facto da base genética da variação morfológica (exemplificada pelos QTLs entre
Q. petræa and Q. robur [Saintagne et al. 2004]) não se correlacionar com os marcadores genéticos
usados para sondar o hibridismo, como verificado em diversas abordagens [Craft et al. 2002, González-Rodríguez et al. 2004a, González-Rodríguez & Oyama 2005, Kelleher et al. 2005, Valbuena-Carabaña
et al. 2005
 ], tornando problemática a interpretação destes últimos face à classificação pela morfologia.
Dois desses estudos, aliás bastante semelhantes porque se observou em ambos uma proporção importante
de indivíduos cuja identificação era contraditória entre critérios morfológicos e genéticos, ilustram as
diferenças de interpretação possíveis neste contexto. No primeiro concluiu-se que a taxa de hibridismo
(entre Q. lobata e Q. douglasii Hook. & Arn.) era muito baixa, e que a morfologia intermédia não é
forçosamente sinal de hibridismo [Craft et al. 2002]; no segundo definiram-se margens arbitrárias de
classificação com base nos genótipos para deduzir introgressão (probabilidade abaixo dos 95%, inclusive
até próximo de 0%!, dum indivíduo estar de acordo com o carácter morfológico utilizado na
identificação) e hibridismo F1 (probabilidade entre 40 e 60%), para obterem perto de 9% de
“introgredidos” (bidireccionalmente; trata-se de Q. petræa e de Q. pyrenaica) e 2–3% de híbridos F1
[Valbuena-Carabaña et al. 2005], que parecem questionáveis pelo menos na metodologia utilizada.
], tornando problemática a interpretação destes últimos face à classificação pela morfologia.
Dois desses estudos, aliás bastante semelhantes porque se observou em ambos uma proporção importante
de indivíduos cuja identificação era contraditória entre critérios morfológicos e genéticos, ilustram as
diferenças de interpretação possíveis neste contexto. No primeiro concluiu-se que a taxa de hibridismo
(entre Q. lobata e Q. douglasii Hook. & Arn.) era muito baixa, e que a morfologia intermédia não é
forçosamente sinal de hibridismo [Craft et al. 2002]; no segundo definiram-se margens arbitrárias de
classificação com base nos genótipos para deduzir introgressão (probabilidade abaixo dos 95%, inclusive
até próximo de 0%!, dum indivíduo estar de acordo com o carácter morfológico utilizado na
identificação) e hibridismo F1 (probabilidade entre 40 e 60%), para obterem perto de 9% de
“introgredidos” (bidireccionalmente; trata-se de Q. petræa e de Q. pyrenaica) e 2–3% de híbridos F1
[Valbuena-Carabaña et al. 2005], que parecem questionáveis pelo menos na metodologia utilizada.
Pelo exposto verifica-se que, para além das dificuldades metodológicas, tem de contar-se com a
diversidade de pressupostos de diferentes autores sobre o fluxo genético entre espécies.
Fluxo genético interespecífico
Os exemplos melhor documentados de pares de espécies que hibridam entre si são, na Europa, Q.
robur / Q. petræa, e na América, Q. gambelii / Q. grisea e Q. laurina Humb. & Bonpl. / Q. affinis
Scheidw., e cada par em situações bastante diferentes dos restantes.
No primeiro [Kleinschmit 1993], têm-se duas espécies cujas distribuições geográficas abrangem
regiões quase coincidentes, embora localmente se verifique uma especialização edafoclimática, com Q.
robur a ocupar locais mais húmidos e “ricos” (supõe-se que edaficamente) e Q. petræa a preferir os mais
secos e quentes; a formação de povoamentos mistos, pelo menos na Alemanha, é favorecida apenas onde
a topografia abrange um mosaico de condições ambientais preferidas por cada uma das espécies; nestes
povoamentos ocorre hibridismo com relativa facilidade, o que poderá eventualmente atribuir-se à
oportunidade de polinização heterospecífica e ao desenvolvimento, previsível em resultado da dispersão
via semente, em condições ecologicamente desfavoráveis. Como se descreveu anteriormente (secção C3,
“emasculação ambiental”), é também em função de condições ambientais limite para Q. gambelii, em
zonas de contacto com Q. grisea, que ocorre hibridação [Williams et al. 2001]. Esta inter-relação entre
limites ecológicos e oportunidade para hibridação é um tema clássico [Dobzhansky et al. 1977, Nason
et al. 1992, Valbuena-Carabaña et al. 2005], mas ao contrário de assumirem-se “débeis mecanismos de
isolamento reprodutor”, importa realçar o facto da hibridação, num par de espécies como no outro, só
ser comum em condições ambientais bastante específicas, e mesmo nessas as tentativas de estimar uma
taxa de hibridação espontânea no primeiro mostram valores em geral modestos (que serão revistos mais
adiante).
No par Q. laurina / Q. affinis, a hibridação pode não relacionar-se com condições-limite
ambientais. A distribuição das duas espécies é apenas parcialmente sobreposta, sendo que a diferenciação
morfológica, baseada em poucos caracteres mas nítida entre populações das regiões alopátricas, se esbate
nas zonas de contacto [González-Rodríguez et al. 2004a, González-Rodríguez & Oyama 2005]. A
hipótese que estas duas espécies se diferenciaram alopatricamente, em cadeias montanhosas afastadas
entre si, para depois, em resposta a climas mais frios, começarem a expandir para zonas de menor altitude
onde entraram em contacto secundário [González-Rodríguez et al. 2004a], permitiria considerar que se
trata de espécies incipientes. Como discutido na parte I, secção A2, pelos critérios bio-sistemáticos a
relativa facilidade de hibridação pode correlacionar-se com um nível infra-específico de subdivisão
 .
Segundo A. González-Rodríguez (comunicação pessoal), existem pelo menos mais 2 táxones que
parecem ser mais próximos de Q. laurina que Q. affinis, com numerosas e complexas reticulações
envolvendo o conjunto das quatro; mesmo que a diferenciação entre estas duas se deva a um pequeno
número de loci sujeitos a selecção disruptiva, esse autor considera que se diferenciam ao nível de
espécie. O mesmo tipo de dúvida se tem colocado quanto às duas formas que se denominam azinheira,
e que hibridam entre si com facilidade em zonas de contacto [Sadaka-Laulan & Ponge 2000],
prevalecendo em muita literatura a ideia de que são espécies diferentes [Rothmaler 1941, Kleinschmit
1993, Govaerts & Frodin 1998] (cf. Apêndice II secção F). Infelizmente, não há critérios objectivos para
estas interpretações (cf. parte I secção A2).
.
Segundo A. González-Rodríguez (comunicação pessoal), existem pelo menos mais 2 táxones que
parecem ser mais próximos de Q. laurina que Q. affinis, com numerosas e complexas reticulações
envolvendo o conjunto das quatro; mesmo que a diferenciação entre estas duas se deva a um pequeno
número de loci sujeitos a selecção disruptiva, esse autor considera que se diferenciam ao nível de
espécie. O mesmo tipo de dúvida se tem colocado quanto às duas formas que se denominam azinheira,
e que hibridam entre si com facilidade em zonas de contacto [Sadaka-Laulan & Ponge 2000],
prevalecendo em muita literatura a ideia de que são espécies diferentes [Rothmaler 1941, Kleinschmit
1993, Govaerts & Frodin 1998] (cf. Apêndice II secção F). Infelizmente, não há critérios objectivos para
estas interpretações (cf. parte I secção A2).
Interpretação dos marcadores nucleares de hibridismo
O estudo de Bacilieri et al. [1996] é frequentemente citado como demonstração da tendência de
hibridação assimétrica entre Quercus robur e Q. petræa, na qual as flores femininas da primeira espécie
seriam fertilizadas por pólen da segunda em percentagens muito consideráveis (48%, pela estimativa
baseada nas plantas de Q. robur). O resultado fundamental deste estudo foram as observações de
variação das frequências em 7 loci enzimáticos durante um ciclo reprodutor (adulto – semente – planta
jovem); assinalando que algumas variações muito significativas das frequências, nas sementes e plantas
derivadas de óvulos de Q. robur, eram no sentido das frequências características dos adultos de Q.
petræa, os autores interpretaram-nas como evidência desse hibridismo. No entanto, tal interpretação é
muito duvidosa (e o considerável trabalho de análise estatística que nela radicou não teria, assim,
qualquer significado), visto que em paralelo se observavam variações semelhantes nos descendentes
derivados de óvulos de Q. petræa (predominância de “genótipos extremos” desta espécie), como ilustra
a figura 2.7.
a)
 b)
b)
 c)
c)
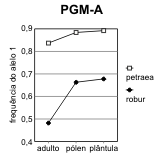
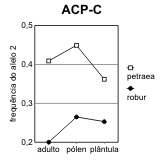
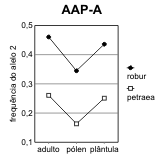
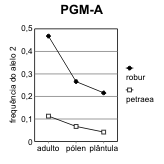
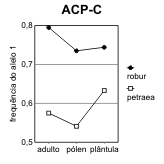
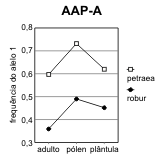
Figura 2.7 — Frequências desde o adulto até à plântula, nos 3 loci de Q. petræa e Q. robur com maiores flutuações
[Bacilieri et al. 1996]. As frequências no pólen foram deduzidas a partir dos genótipos das sementes, por referência
aos das árvores donde foram colhidas. Separam-se as ilustrações para cada um dos dois alelos mais frequentes (1,
2) de cada locus. A significância das diferenças de frequência referem-se às frequências nos adultos na mesma
espécie. a) locus ACP-C (diferenças não-significativas); b) locus AAP-A (significativas no pólen das duas espécies);
c) locus PGM-A (significativas nas plântulas das duas espécies, e no pólen de Q. robur).
Assim, o que para Bacilieri et al. [1996] são taxas de hibridismo, mais não é do que medidas de
flutuação de frequências, intra-específicas, dentro de um ciclo de vida.
A análise feita pelo mesmo grupo dum povoamento misto destas duas espécies, mas com
marcadores nSSR [Streiff et al. 1999], determinou que, em 310 descendentes de pólen de progenitores
genotipados, 23 formaram-se com pólen heterospecífico; no entanto, 16 desses híbridos descendiam do
indivíduo B (Q. petræa), totalmente rodeado por Q. robur de tal maneira que só 5 descendentes de B
descendiam de pólen conspecífico do mesmo povoamento. Esta taxa de 70% de hibridismo
intrapovoamento (16 em 21) reflecte sem dúvida a importância das árvores mais próximas e, por
extensão, a da topografia, na promoção do hibridismo entre Quercus. Assim, uma melhor aproximação
à verdadeira incidência de hibridismo teria de fazer-se sem os dados da árvore B, dando 7/289 = 2,4%,
mas como apenas se trata das polinizações intrapovoamento (649 descendentes derivaram de pólen de
origem exterior, não se sabendo nesses casos a espécie) este número será provavelmente uma estimativa
por excesso. Tem-se assim uma indicação adicional que as taxas elevadíssimas propostas por Bacilieri
et al. [1996] se baseiam em pressupostos errados, como discutido acima. Por sinal, a identidade da planta
B constitui um contra-exemplo para o observado com polinizações controladas, onde se assume que a
direcção preferencial de hibridação é a oposta, isto é, ser mais frequente haver hibridação envolvendo
pólen de Q. petræa em flores femininas de Q. robur (cf. secção C3). O facto dessas polinizações não
envolverem misturas de pólen das duas espécies tornam as taxas de sucesso na hibridação irrelevantes.
A verificação duma baixa taxa de hibridismo entre Q. robur e Q. petræa, baseada em vinte loci
nSSR [Muir & Schlötterer 2005], só seria compatível com a presença dos mesmos marcadores genéticos
nas duas espécies (e nas mais variadas proveniências) se mantida por fluxos genéticos interespecíficos
bastante intensos; a melhor explicação dada pelos autores foi (excluindo tratar-se de homoplasias) a
persistência de polimorfismos anteriores à especiação.
DNA citoplásmico
É na suposição de que vários pares de espécies hibridam entre si frequentemente que se inserem
algumas sugestões de explicação para os intrigantes resultados obtidos com DNA citoplásmico em
Quercus. Estes marcadores genéticos parecem não ser alvo de qualquer forma de recombinação, deste
modo fixando como introgressão o DNA citoplásmico duma espécie que tenha sido polinizada por outra
e, com a intervenção do pólen desta segunda espécie, produza populações morfologicamente
indistinguíveis do “tipo” botânico desta última. Praticamente todos as espécies europeias da secção
Quercus que foram analisadas partilham 3 ou mais haplótipos de DNA citoplásmico entre si [Dumolin-Lapègue et al. 1997a, Petit et al. 2002], a tal ponto que a filogeografia no grupo (traçamento das rotas
migratórias desde a última glaciação) só pode ser de haplótipos e não de espécies.
Quando se analisa a variação do DNA plastidial a uma escala geográfica intermédia, observa-se
um fenómeno de colocalização de haplótipos de diferentes espécies, como foi primeiro documentado
numa região do oeste de França (com cerca de 50000 Km2) com numerosos povoamentos mistos de Q.
robur e Q. petræa [Petit et al. 1997]: embora houvesse no conjunto 6 haplótipos plastidiais diferentes,
em cada povoamento misto observava-se em geral um único haplótipo, comum às duas espécies (tabela
2.1 [Petit et al. 1997]).
Tabela 2.1 — Colocalização de haplótipos de DNA plastidial idênticos entre as espécies Q. robur e Q.
petræa. Combinações de haplótipos entre árvores nas mesmas parcelas, evidenciando uma larga maioria de
parcelas (≈115/137) onde as duas espécies têm o mesmo haplótipo. Os casos sem correspondência referem-se
a análises apenas duma das espécies [Petit et al., 1997].
|
|
|
Haplótipos em Q. petræa
|
|
|
1
|
2
|
3
|
4
|
5
|
6
|
s/ corresp.
|
|
|
1
|
64
|
3
|
3
|
3
|
1
|
0
|
7
|
|
2
|
1
|
26
|
0
|
2
|
0
|
0
|
15
|
|
3
|
3
|
3
|
≈20
|
0
|
0
|
0
|
2
|
|
4
|
3
|
1
|
1
|
5
|
0
|
0
|
7
|
|
5
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
6
|
1
|
0
|
0
|
0
|
0
|
0
|
0
|
|
|
s/ corresp.
|
6
|
1
|
1
|
2
|
0
|
0
|
|
|
Segundo esta hipótese, que é discutida em grande detalhe num trabalho recente [Petit et al. 2003],
os povoamentos foram iniciados por Q. robur (espécie ecologicamente mais pioneira que Q. petræa),
em vagas de colonização independentes após o recuo dos gelos da última glaciação, de tal modo que
actualmente cada povoamento tem praticamente um único haplótipo plastidial; a seguir, o pólen de Q.
petræa poderia dar origem a híbridos com os Q. robur nestes povoamentos, a partir dos quais, em
sucessivas gerações de retrocruzamento com pólen de Q. petræa, e presumindo-se selecção disruptiva
com uma melhor adaptação dos carvalhos mais “puros” (incluindo a sua tolerância ao ensombramento
por Q. robur), se instalariam os antecessores dos actuais Q. petræa — estes, então, seriam típicos da
espécie excepto pela introgressão do DNA plastidial de Q. robur, que testemunha a ocorrência de
hibridismo como evento iniciador da colonização por Q. petræa.
Num trabalho subsequente, o mesmo processo foi invocado para explicar padrões de aparente
introgressão entre Q. suber e Q. ilex ssp. rotundifolia [Belahbib et al., 2001], desta vez com o termo
“captura nuclear”, mais tarde dando lugar ao de “submersão polínica” (pollen swamping) [Petit et al.
2003]. A partilha de haplótipos plastidiais, e a tendência para cada haplótipo coexistir em diferentes
espécies nos mesmos locais, tinham sido observadas primeiro na secção Albæ [Whittemore & Schaal,
1991] e foram descritos recentemente vários casos semelhantes, com maior ou menor complexidade
[Bordács 2000, Collada et al. 2002, Finkeldey & Mátyás 2003, González-Rodríguez et al. 2004b,
Lumaret et al. 2005]; porém, nem sempre se trata de espécies que se conformem com os requisitos da
hipótese original [Petit et al. 1997] e ainda menos com o conjunto de factores ecológicos enumerados,
especificamente para o par Q. petræa / Q. robur, para o sucesso da “submersão polínica” [Petit et al.
2003], a qual só se concebe dentro dum pressuposto de facilidade de hibridação que, mesmo para este
par de espécies, é duvidoso.
A tendência de colocalização de haplótipos de espécies aparentadas é, contudo, um fenómeno bem
estabelecido e, a não ser levado em conta, pode dar azo a erros grosseiros de interpretação filogenética
[Lumaret et al. 2005]. Quanto à possibilidade do polimorfismo destes marcadores anteceder a especiação
[González-Rodríguez et al. 2004b] pode ter alguma validade, mas em si não explica a diferenciação
geográfica ser por haplótipos e não por espécies.
Toda esta situação com os marcadores de DNA plastidiais tem dado origem a afirmações pouco
credíveis, como por exemplo “ser opinião corrente” que os genes nucleares não são tão facilmente
trocados entre espécies de Quercus como os citoplásmicos [Zoldos et al. 2001], ou proporem-se
[Belahbib et al. 2001] “trocas citoplásmicas frequentes” (sem as quais a submersão polínica não
funcionaria) entre espécies que “não são muito aparentadas” (preconceito relacionado com o esquema
taxonómico da Flora Europæa, cf. parte I secção A2).
A que parece ser a melhor explicação para estas observações entronca no conceito de multi-espécie
[Burger 1975], especialmente plausível nos refúgios glaciares, onde seria comum haver indivíduos
isolados dos da mesma espécie, ou em condições de emasculação ambiental, de tal modo que a
reprodução sexuada poderia facilmente envolver hibridismo — e ocasionalmente ser essa a única
possibilidade para além da autopolinização. Ao fim de várias gerações nessa situação, e com a fixação
por deriva (que é maior nos genes transmitidos uniparentalmente), é plausível que se desse a
uniformização do haplótipo em cada refúgio; quando houvesse nova expansão e se fosse restabelecendo
(por selecção disruptiva) a primitiva diferenciação entre espécies, as populações na mesma rota de
migração teriam retido a marca da sua origem geográfica comum (refúgio glaciar) no seu DNA
citoplásmico [Valbuena-Carabaña et al. 2005]. Esta explicação já havia sido avançada para a partilha
de marcadores AFLP (nucleares) entre três espécies da secção Stenocarpæ [Kashani & Dodd 2002].
Uma das propriedades interessantes do DNA citoplásmico é permitir verificar, em teoria, se o fluxo
genético interespecífico tem um sentido preferencial ou é bidireccional, independentemente de quando
se tenha dado. O exemplo mais notável desta inferência é do par Q. suber / Q. ilex, pois é frequente
encontrarem-se haplótipos ‘ilex’ no primeiro mas não vice-versa, indicando que o hibridismo se
processaria preferencialmente entre pólen de Q. suber e flores femininas de Q. ilex [Belahbib et al. 2001,
Collada et al. 2002, Jiménez et al. 2004]. Embora a evidência de polinizações controladas neste par deva
ser interpretada com precaução (cf. secção C3), ela é concordante [Boavida et al. 2001], o mesmo
podendo dizer-se quanto a identificarem-se os haplótipos presentes em Q. afares como sendo de Q. suber
[Mir et al. 2006], os de Q. × fagineomirbeckii de Q. faginea [Morales et al. 2005] e, talvez, os de Q.
petræa como sendo de Q. robur [Petit et al. 2003].
 Figura 2.4 — Ilustração dos estádios de desenvolvimento definidos por Varela & Valdivieso
[1996] para sobreiro, com a gentil cedência de M. C. Varela. Na fila superior, flores femininas, na
inferior, amentilhos (excepto na fase F2, pormenor das anteras em ântese).
Figura 2.4 — Ilustração dos estádios de desenvolvimento definidos por Varela & Valdivieso
[1996] para sobreiro, com a gentil cedência de M. C. Varela. Na fila superior, flores femininas, na
inferior, amentilhos (excepto na fase F2, pormenor das anteras em ântese).