Apêndice III: protocolos, tinas de electroforese e formulário
1) Preparação de extractos enzimáticos
a) Pesar 400 mg de folhas após retirar os pecíolos, limpas e na medida do possível sem parasitas,
defeitos ou áreas necrosadas, e colocá-las num almofariz. Caso se utilizem sementes, corta-se
uma calote de poucos milímetros da extremidade mais larga (a que se insere na cápsula do
fruto, implicando apenas a porção distal dos cotilédones) e secciona-se em lâminas finas para
facilitar a maceração
![]() .
.
b) Verter aproximadamente 25 mL de azoto líquido sobre as folhas e macerá-las até evaporar-se o azoto e repetir (sugestão: usar uma colher de 50 mL para retirar o azoto líquido da garrafa e repartir em duas metades por dois almofarizes, apenas um contendo as folhas; para a repetição é suficiente transferir o azoto ainda existente no segundo almofariz). É importante reduzir as folhas a pó (figura 3.2 a), principalmente no caso das azinheiras jovens, cujas folhas são muito fibrosas.
c) Com a ajuda de uma espátula e usando um funil, transferir o pó para um tubo de 2 mL e pipetar 1 mL de meio de extracção (usando de preferência uma pipeta de Pasteur de plástico (por exemplo Brand BRAA747755), agitando o conteúdo com o tubo fechado de modo a assegurar que todo o pó fica embebido pelo líquido. Colocar o tubo no banho de gelo.
d) A cada tubo contendo um macerado de folhas embebido em meio de extracção, realizar uma homogenização durante 10 segundos (com um homogenizador de lâminas, por exemplo o modelo X120 da marca CAT, Staufen, Alemanha, munido com a sonda T6), à velocidade máxima e imerso no banho de gelo. Apesar desta imersão, mais tempo implica acumulação de calor que pode inactivar enzimas; por isso, para facilitar a homogenização é muito importante ter conseguido pulverizar as folhas completamente no passo b (maceração em azoto líquido), assim como é recomendável fazer uma pré-homogenização a velocidade reduzida, geralmente com a duração de 10 a 20 segundos (figura 3.2 b, c).
e) Centrifugar os tubos com os homogenatos durante 10 minutos a 5000 g e retirar 100 µL de sobrenadante (de cor amarelo dourado a verde, segundo a proporção de cloroplastos em suspensão, figura 3.2 c; no caso dos extractos de cotilédones e de folhas albinas, são quase transparentes) para um tubo de plástico de 0,5 mL contendo 5 µL do cocktail de inibidores a 20× (ou 10 µL do cocktail a 10×) e misturar bem. Devem processar-se no máximo 6 amostras por centrifugação para que nenhuma espere demasiado tempo até esta transferência ser completada. Além disso, verificou-se que este ritmo permite 2 pessoas alternarem eficientemente na utilização dos mesmos equipamentos, isto é, uma está a realizar os passos a–c enquanto a outra está nos d–e), duplicando o número de amostras que se podem processar para o mesmo período de tempo.
f) Guardar os extractos a -20 ºC (podem esperar uma ou duas horas no banho de gelo enquanto outras amostras estão a ser processadas), só devendo sair desta temperatura o tempo estritamente necessário para aplicação nos géis (protocolo 3).
2) Dissolução do amido e sua aplicação no molde do gel
a) Preparar previamente o molde do gel: sobre vidro temperado de 4 mm de espessura com 24,6 cm × 20,6 cm, fixar com molas de escritório 4 barras de acrílico com 1,9 cm de largura e 1,2 cm de altura, tal que se defina, sem fugas, um paralelipípedo com 20,8 cm (largura, lado maior) × 16,8 cm (eixo da corrente, lado menor) × 1,2 cm disponível para ser ocupado pelo amido dissolvido e formar-se o gel.
b) Suspender o amido homogeneamente em cerca de 1/3 (90 a 100 mL) do tampão de gel dentro de um frasco Kitasato de 1 L, enquanto se fervem os restantes 2/3 do tampão num forno de micro-ondas.
c) Verter a solução fervente sobre a suspensão de amido, para formar a solução viscosa que se homogeneiza rapidamente agitando o frasco com a mão).
d) Colocar a solução sobre um bico de Bunsen, agitando-se cada 10 segundos aproximadamente, até que (normalmente em menos de 1 minuto) se formam grandes bolhas de gás a subirem pela superfície interna do frasco.
e) Desgaseificar a solução, vedando a boca do frasco com uma rolha e ligando-o pela abertura lateral a uma linha de vácuo (tromba de água de preferência, ou então uma bomba de vácuo suficientemente potente). A ebulição aumenta substancialmente de início, por isso tem de evitar-se que atinja a saída para a linha de vácuo — eventualmente será necessário afrouxar ligeiramente a sucção. Ao fim de cerca de meio minuto de desgaseificação a ebulição já deve ter-se reduzido, e não convém que se prolongue demasiado este passo, especialmente porque pode alterar a viscosidade da solução [May 1991].
f) Na altura de verter para o molde do gel retira-se o tubo de união à linha de vácuo (de modo nenhum se deve desligar o vácuo enquanto está ligado ao frasco, por perigo de refluxo a partir da linha de vácuo) e verte-se para o molde, que deve estar ligeiramente inclinado para facilitar o espalhamento da solução.
3) Colocação das amostras no gel
1. Retiram-se as barras de acrílico e coloca-se o gel, orientado com o lado maior paralelo ao plano dos olhos (figura 3.3 a).
2. Com fio de pesca, separar do vidro os cerca de 3 a 6 cm de gel mais próximos (figura 3.3 a).
3. Sem retirar o fio de baixo do gel, fixar firmemente um dos lados do fio e produzir uma fenda paralela ao lado maior do gel levantando o fio do outro lado com um movimento relativamente rápido (figura 3.3 b).
4. Deslizar a porção mais pequena do gel de modo a abrir a fenda em cerca de 2 mm (figura 3.3 c).
5. Colocar o gel sobre os acumuladores de frio a serem utilizados durante a electroforese para efectuarem a refrigeração. Retirar as amostras (cada uma contendo um extracto a analisar) do congelador para um banho de gelo, ordenando-as em grupos de 10.
6. Transferir uma porção de cada amostra para a fenda aberta no gel, colocando na posição respectiva, em contacto com a porção maior do gel, um aplicador de papel Whatman nº 1 com aproximadamente 1 cm × 0,3 cm depois de embebido na amostra correspondente; apenas cerca de 2/3 da altura do aplicador são embebidos [May 1991], e o excesso de líquido é removido com papel absorvente; manipula-se o aplicador com uma pinça microcirúrgica.
7. Ao fim de cerca de 5–10 minutos, fecha-se a fenda e procede-se à montagem do dispositivo de electroforese.
B — Montagem das tinas com os eléctrodos
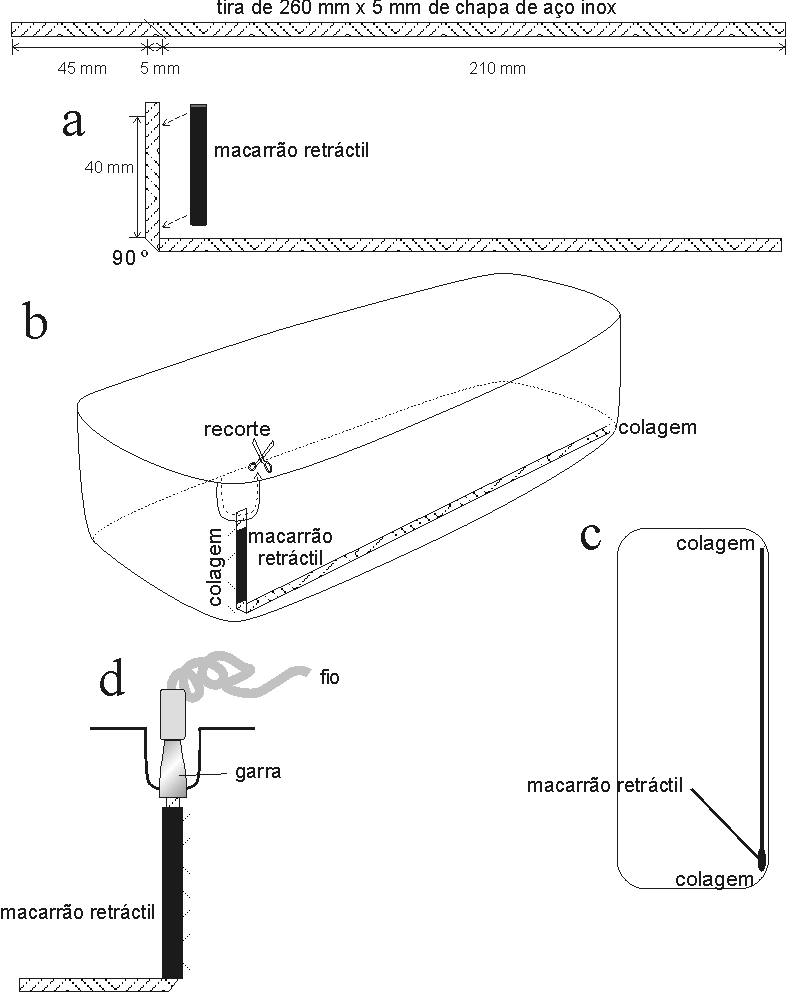 Figura 6.7 — Montagem das tinas com os eléctrodos a partir de caixas de plástico e tiras
de aço inoxidável. a) Dobragem da tira de aço e protecção com macarrão retráctil (isolador).
b) Posicionamento do eléctrodo na tina, com indicação dos pontos de colagem (cola de silicone)
e recorte do rebordo da tina para expor a extremidade do eléctrodo. c) Planta da tina. d)
Pormenor da tina vista pelo lado de dentro, mostrando a ligação à fonte de voltagem através
duma garra que contacta com o eléctrodo.
Figura 6.7 — Montagem das tinas com os eléctrodos a partir de caixas de plástico e tiras
de aço inoxidável. a) Dobragem da tira de aço e protecção com macarrão retráctil (isolador).
b) Posicionamento do eléctrodo na tina, com indicação dos pontos de colagem (cola de silicone)
e recorte do rebordo da tina para expor a extremidade do eléctrodo. c) Planta da tina. d)
Pormenor da tina vista pelo lado de dentro, mostrando a ligação à fonte de voltagem através
duma garra que contacta com o eléctrodo.
Mantiveram-se as soluções descritas na tabela 6.4, para mais rápida preparação das soluções de trabalho:
Tabela 6.4 — Soluções prontas a usar.
Solução |
Volumea |
Medições |
Comentáriosb |
Acetato de sódio 0,1 M pH 5,0 (AcNa) |
1 L |
8,822 g de acetato de sódio (tri-hidrato, Merck 106267) |
Dissolver em 800 mL de água, titular pH com aproximadamente 2 mL ácido acético glacial e aferir volume final com água |
Ácido bórico 0,5 M |
2 L |
61,83 g de ácido bórico (Merck 100165) |
|
Ácido cítrico 1 M |
250 mL |
52,535 g de ácido L-cítrico (mono-hidrato, Merck 100244 ou Sigma C-7129) |
|
AEBSF 10 mM |
5 mL |
300 mg de AEBSF (Calbiochem 101500) |
Conservação a 4 ºC em volumes de 500 μL |
BSA 50 mg/mL |
10 mL |
500 mg de albumina de soro de bovino, fracção V (Sigma A-7906) |
Conservação a –20 ºC em volumes de 1 mL |
CaCl2 1 M |
50 mL |
10,95 g CaCl2 ·6H2O (Merck 2072) |
Fortemente higroscópico |
DTT 1M |
10 mL AcNa |
1,5425 g de ditiotreitol (Promega V315A) |
Dissolução em acetato de sódio 0,1 M pH 5,0, conservação a –20 ºC em volumes de 1 mL |
E-64 1 mM |
2,8 mL |
1 mg de E-64 (o conteúdo dum tubo, no caso do reagente da Calbiochem 324890) |
A dissolução é bastante difícil e procedeu-se do seguinte modo: o E-64 suspenso na água era transferido para um tubo de 4 mL, onde se usava o homogenizador para efectuar a dissolução. Conservação a –20 ºC em volumes de 400 μL |
EDTA 0,5 M pH 8,0 |
100 mL |
18,61 g de EDTA (sal dissódico de tetra-acetato de etilenodiamina di-hidrato, BDH 28025) |
Feita a suspensão em 80 mL de água, com agitação, titula-se para pH 8,0 com aproximadamente 15 mL NaOH 5 N, para dissolver, aferindo o volume final com água |
Fosfato básico 0,2 M |
1 L |
28,392 g Na2HPO4 (J. T. Baker 0306) |
|
Fosfato ácido 1 M |
250 mL |
34,498 g NaH2PO4·H2O (J. T. Baker 0303) |
|
Fosfato 1 M pH 6,0 |
250 mL |
34,498 g NaH2PO4·H2O (J. T. Baker 0303) |
Dissolver em 220 mL de água, titular pH com aproximadamente 18 mL de NaOH 5 N, aferir volume final com água |
Fosfato 0,1 M pH 7,0 |
250 mL |
72,1 mL fosfato básico 0,2 M + 10,6 mL fosfato ácido 1 M |
Quantidades exactas para o volume pretendido [Sambrook et al. 1989], não é necessário corrigir |
Fosfato 0,1 M pH 7,5 |
250 mL |
105 mL fosfato básico 0,2 M + 5 mL fosfato ácido 1 M |
Dilui-se para 240 mL e corrige-se pH com aproximadamente 2,5 mL NaOH 0,5 N |
H2O2 3% |
100 mL |
10 mL H2O2 a 30% (Aldrich 21676-3) |
Conservação a 4 ºC |
HCl 1 N |
250 mL |
21,55 mL de ácido clorídrico concentrado (37%) |
Fumos intoxicantes |
Iodoacetato 100 mM |
15 mL |
288 mg de ácido iodoacético (Sigma I-1014) |
Conservação a –20 ºC em volumes de 1,5 mL |
KI 0,1 M |
1 L |
16,6 g iodeto de Potássio (May & Baker) |
|
Lactato 0,5 M pH 7,0 |
250 mL |
11 mL ácido DL-láctico 85% (Sigma L-1250) |
|
LiOH 1 M |
1 L |
41,96 g de hidróxido de lítio (Sigma L-4256) |
|
MgCl2 1 M |
100 mL |
20,331 g de cloreto de magnésio (hexa-hidrato, BDH 29096) |
Fortemente higroscópico |
DL-Malato 0,5 M |
250 mL |
16,75 g ácido DL-málico (Sigma M-0875) |
Juntar 27,5 g NaHCO3 (Sigma S-8875), pH final neutro [May 1991] |
L-Malato 0,3 M pH 7,0 |
100 mL |
4,02 g ácido L-málico (Sigma M-1000) |
Juntar 6,6 g NaHCO3, pH final neutro |
MTT 10 mg/mL |
50 mL |
500 mg de brometo de 3-(4,5-dimetil-2-tiazolil)-2,5-difenil-2H-tetrazólio (Merck 111714) |
Solução quase saturada. Conservação a –20 ºC em volumes de 1 mL. Depois de descongelado, pode apresentar precipitado, mas dissolve-se bem na solução de revelação. |
NAD 20 mg/mL |
50 mL |
1 g NAD (Sigma N-7004) |
Conservação a –20 ºC em volumes de 1 mL. |
NaOH 0,5 N |
250 mL |
5 g de hidróxido de sódio |
|
NaOH 5 N |
100 mL |
20 g de hidróxido de sódio |
Fortemente exotérmica |
PMS 2 mg/mL |
50 mL |
100 mg de metosulfato de fenazina (Sigma P-9625) |
Conservação a –20 ºC em volumes de 1 mL [Worsfold et al. 1977] |
Tio-sulfato de sódio 0,1 M |
250 mL |
6,205 g de tio-sulfato de sódio (Sigma S-8503) |
|
Tris 2 M |
250 mL |
60,57 g de Tris base (tris-etanolamina hidroxilo Merck 108382) |
|
Tris 1 M pH 8 |
250 mL |
30,285 g de Tris base |
Dissolver em 230 mL de água, titular pH com aproximadamente 9,5 mL de HCl concentrado (37%), aferir volume final com água |
Tris 1 M pH 8,5 |
250 mL |
30,285 g de Tris base |
Dissolver em 230 mL de água, titular pH com aproximadamente 8 mL de HCl concentrado (37%), aferir volume final com água |
Tris 1 M c/ Mg pH 9,0 |
100 mL |
50 mL Tris 2 M + 5 mL MgCl2 1 M |
Dilui-se para 90 mL e corrige-se pH com aproximadamente 2,5 mL HCl 1 N |
a Dissolução em água excepto onde especificado
b Conservação à temperatura ambiente excepto onde especificado
2) Meio de extracção de enzimas
Para 100 mL:
Pesar 388 mg de L-histidina (Sigma H-8000), 456 mg de Ácido N-(2-acetamido)-2-aminoetanosulfónico (ACES, Merck 115226), 4,952 g de ascorbato de sódio (Sigma A-7631) e 12,5 g de polivinilpirrolidona (Sigma PVP40T ou PVP40), dissolvendo-os em 48 mL de água com uma espátula. Misturar bem estes 4 sólidos antes de juntar a água, e adicionar a água progressivamente à medida que a “pasta” de PVP40 se vai hidratando. A dissolução é ligeiramente exotérmica e o líquido acumula muitas bolhas de gás.
Juntar 25 mL de etilenoglicol (Sigma E-9129), 8 mL de sulfóxido de metilo (DMSO, Aldrich 47230-1), 2 mL de EDTA 0,5 M pH 8,0, 500 μL de DTT 1 M, e 4 mL de BSA a 50 mg/mL.
Numa proveta graduada, perfazer os 100 mL com água (geralmente é necessário um volume inferior a 1 mL). Registar o valor do pH (deve estar perto do valor 6,5, mas ocasionalmente pode chegar a 6,7). Guardar a –20 ºC.
3) Cocktails de inibidores de proteases
Fórmula A (a mais frequentemente utilizada), 20×:
Para 500 µL (cerca de 100 amostras), adicionar 100 μL AEBSF a 10 mM + 100 μL E-64 a 1 mM + 100 μL iodoacetato a 100 mM + 200 μL EDTA a 0,5 M pH 8,0. Uma vez preparado, este cocktail é utilizável no prazo de poucos dias se mantido sempre a 4 ºC. Utilizam-se 5 µL por cada 95 µL de extracto, tal que as concentrações dos inibidores no extracto são:
AEBSF. . . . . . . . . . . . . . . .100 µM
E-64. . . . . . . . . . . . . . . . . . .10 µM
Iodoacetato. . . . . . . . . . . . . . 1 mM
EDTA. . . . . . . . . . . . . . . . . 10 mM
Fórmula B, 10×:
Hidratação da fórmula de uso genérico da Sigma, fornecida na forma de pó liofilizado (Sigma P-2714, lote 28H5855), conforme as indicações do fabricante. Usando uma seringa hipodérmica, injectar 10 mL de água no frasco com o liofilizado. Completada a dissolução, distribuir por volumes de 250 μL, congelando a –20 ºC. Uma vez descongelado para utilização, conserva-se a 4 ºC durante alguns dias. As concentrações dos inibidores no extracto são, segundo o folheto que acompanha este produto:
AEBSF. . . . . . . . . . . . . . . . . 2 mM
E-64. . . . . . . . . . . . . . . . . . .14 μM
Bestatina. . . . . . . . . . . . . . 130 μM
Leupeptina. . . . . . . . . . . . . . .1 μM
Aprotinina. . . . . . . . . . . . . .0,3 μM
EDTA. . . . . . . . . . . . . . . . . . 1 mM
4) Soluções de revelação dos isoenzimas
Tabela 6.5 — Preparação das soluções de revelação, ordenadas pelo acrónimo adoptado para cada actividade enzimática. Na segunda coluna consideram-se 2 tipos: imersão (em geral 100 mL de solução para 2 geis) ou camada de agarose (20 mL de solução para 2 geis). Cada solução começa pela pesagem dos componentes sólidos, adicionados ao recipiente pela ordem indicada, a que se juntam os componentes líquidos, também pela ordem indicada. A G6PD é de Leuconostoc mesenteroides (Sigma G-8404), que permite a utilização de NAD em vez de NADP nas incubações, que se torna bastante mais barata. Os 10 mL de agarose consistem de 160 mg de agarose tipo I-A (Sigma A-0169), dissolvida em 10 mL de água no forno de micro-ondas, deixando-se arrefecer para aproximadamente 50 ºC antes de adicionar à restante solução de revelação. Actividades que nunca foram observadas têm resultado com ponto de interrogação. A referência do fornecedor só é incluída para a 1ª ocorrência de cada reagente.
Activ. |
Tipo |
Sólidos |
Líquidos |
Incubação |
Resultado |
0DH |
Imersão |
— |
10 mL Tris 1 M pH 8,5 + 88 mL água + 1 mL MTT + 1 mL PMS |
Escuro, t.a., 2 horas |
bandas azul-escuro sobre fundo branco |
AAT |
Imersão |
72 mg ácido α-cetoglutárico (Sigma K-1750) + 544 mg L-Asp (Sigma A-9256) + 50 mg piridoxal fosfato (Sigma P-9255) + 100 mg Fast Blue BB (Sigma F-0250) |
10 mL Tris 1 M pH 8,5 + 80 mL água + 50 μL EDTA 0,5 M pH 8,0 + NaOH 0,5 N para pH 8,0 + água |
Escuro, t.a., durante a noite |
Bandas azul-esverdeado sobre fundo laranja |
ACP |
Imersão |
100 mg ácido α-naftil fosfato (sigma N-7000) + 10 mg Fast Garnet sal GBC (90%, Sigma F-8761) |
50 mL AcNa 0,1 M pH 5,0 + 50 mL água |
t.a., durante a noite |
bandas grená sobre fundo alaranjado |
ACP-F |
Imersão |
50 mg metilumbeliferil-fosfato (Sigma M-8883) |
50 mL AcNa 0,1 M pH 5,0 |
Escuro, t.a., 30-60 min. |
Fluorescente |
ADH |
Imersão |
— |
10 mL Tris 1 M pH 8,5 + 86 mL água + 1 mL MTT + 1 mL PMS + 2 mL etanol (Merck 100983) |
Escuro, t.a., 2 horas |
bandas azul-escuro sobre fundo branco |
AKP |
Imersão |
100 mg ácido α-naftil fosfato + 10 mg Fast Garnet sal GBC |
10 mL Tris 1 M pH 8,5 + 90 mL água |
t.a., durante a noite |
? |
ALD |
Agarose |
75 mg fructose 1,6-difosfato (Sigma 752-1) + 25 mg arsenato de sódio (Sigma A-6756) |
1 mL Tris 1M pH 8,5 + 1 mL NAD + 6 mL água + 1 mL MTT + 40 U GAPD (Sigma G-0763) + 1 mL PMS+ 10 mL agarose |
Escuro, 37 ºC, 2 horas, e t.a. durante a noite |
bandas azul |
CAT |
Imersão |
— |
10 mL fosfato 0,1 M pH 7,0 + 7 mL tio-sulfato 0,1 M + 5 mL H2O2 3% + 78 mL água |
t.a. 5–15 minutos |
Descartar a solução e juntar KI 0,1 M; ao fim de 15–30 minutos, bandas brancas sobre fundo negro-azulado; parar com água |
DIA |
Imersão |
1 a 2 mg DCPI (2,6-diclorofenolindofenol, Sigma D-1878) + 25 mg NADH (Merck 124644) |
10 mL tris 1 M pH 8,5 + 89 mL água + 1 mL MTT |
Escuro, t.a., até 2 horas |
bandas carmim sobre fundo azul, tornando-se azul sobre fundo claro após diferenciação |
EST |
Imersão |
A: 40 mg α-naftil acetato (Sigma N-8505) + 40 mg α-naftil butirato (Sigma N-8000) B: 100 mg Fast Blue BB |
solução A: dissolver sólido em 1 mL acetona (J. T. Baker 8002) a 0 ºC e conservar no gelo; sol. B: 10 mL fosfato 1 M pH 6,0 + 90 mL água e dissolver sólido. Misturar A + B |
t.a. durante a noite |
bandas cinzento-escuro sobre fundo avermelhado |
EST-F |
Imersão |
60 mg metilumbeliferil-acetato (Sigma M-0883) |
10 mL fosfato 1 M pH 6,0 + 90 mL água |
Escuro, t.a., 30-45 min. |
Fluorescente |
FBP |
Imersão |
40 mg fructose 1,6-difosfato + 50 mg arsenato de sódio |
10 mL Tris 1 M pH 8,5 + 87 mL água + 1 mL NAD + 1 mL MTT + 100 μL MgCl2 1 M + 100 U PGI (Sigma P-5381) + 60 U G6PD + 1 mL PMS |
Escuro, 37 ºC, 2 horas, e t.a. durante a noite |
? |
G2D |
Imersão |
100 mg ácido DL-glicérico (Sigma G-7274) |
10 mL Tris 1M pH 8,5 + 87 mL água + 1 mL NAD + 1 mL MTT + 1 mL PMS |
Escuro, t.a., 2 horas |
bandas azul-escuro sobre fundo branco |
G6PD |
Imersão |
100 mg fructose 6-fosfato (Sigma F-3627 ou Calbiochem 344342) + 10 mg NADP (Merck 124541) |
10 mL Tris 1M pH 8,5 + 87,5 mL água + 0,5 mL MgCl2 1M + 1 mL MTT + 50 U PGI + 1 mL PMS |
Escuro, 37 ºC, 2 horas |
bandas azul |
GAPD |
Imersão |
55 mg fructose 1,6-difosfato + 150 mg arsenato de sódio |
10 mL Tris 1 M pH 8,5 + 87 mL água + 1 mL NAD + 1 mL MTT + 50 μL ALD (Sigma A-9562) + 1 mL PMS |
Escuro, 37 ºC, 2 horas, e t.a. durante a noite |
bandas azul |
GDH |
Agarose |
120 mg ácido L-glutâmico (Fluka 49450) + 60 mg ADP (Sigma A-2754) |
2 mL tris 1 M pH 8,5 + 4 mL água + 20 μL EDTA 0,5 M pH 8,0 + NaOH 5 N (acertar pH para 8,0) + ~1 mL água + 1 mL NAD + 0,5 mL MTT + 1 mL PMS + 10 mL agarose |
Escuro, 37 ºC, 2 horas, e t.a. durante a noite |
bandas azul-escuro sobre fundo azul-claro |
GPT |
Imersão |
20 mg NADH + 360 mg DL-Ala (Sigma A-7502) + 38 mg ácido α-cetoglutárico |
19 mL água + < 0,5 mL Tris 2 M (titular para pH 7,6) + 2 gotas LDH (Sigma L-2500) |
Escuro, t.a., 1-2 horas |
Fluorescência negativa |
GsR |
Agarose |
50 mg glutationa oxidada (GSSG, Sigma G-4376) + 5 mg NADPH (Merck 124540) + 1–2 mg DCPI |
1 mL Tris 1 M pH 8,5 + 8 mL água + 1 mL MTT + 10 mL agarose |
Escuro, 37 ºC, 2 horas |
bandas azul-claro sobre fundo branco |
HXK |
Imersão |
90 mg D-glucose (J. T. Baker 0114) + 10 mg NADP + 50 mg ATP (Merck 101432) |
10 mL Tris 1 M pH 8,5 + 88 mL água + 100 μL MgCl2 1 M + 1 mL MTT + 60 U G6PD + 1 mL PMS |
|
|
IDH |
Agarose |
75 mg ácido DL-isocítrico (Sigma I-1252) + 10 mg NADP |
1 mL Tris 1 M pH 8,5 + 6,5 mL água + 0,5 mL MgCl2 1 M + 1 mL MTT + 1 mL PMS + 10 mL agarose |
Escuro, t.a., 2 horas |
bandas azul-escuro sobre fundo branco |
LAP |
Imersão |
20 mg L-leucil-β-naftilamida (Sigma L-0376) + 10 mg Fast Garnet sal GBC (90%) |
100 mL Tris 0,05 M pH 7,0 (titulando o de pH 8,0 com HCl 1N) |
t.a., durante a noite |
bandas carmim sobre fundo laranja |
LDH |
Imersão |
— |
10 mL DL-lactato 0,5 M pH 7,0 + 10 mL Tris 1 M pH 8,5 + 1 mL NAD + 77 mL água + 1 mL MTT + 1 mL PMS |
Escuro, 37 ºC, 2 horas |
bandas azul |
MDH |
Imersão |
— |
10 mL tris 1 M pH 8,5 + 5 mL malato 0,5 M + 82 mL água + 1 mL NAD + 1 mL MTT + 1 mL PMS |
Escuro, t.a., até 2 horas |
bandas azul-escuro sobre fundo branco |
ME |
Imersão |
20 mg NADP |
10 mL ácido L-málico 0,3 M pH 7,0 + 10 mL tris 1 M pH 8,5 + 82 mL água + 2 mL MgCl2 1 M + 1 mL MTT + 1 mL PMS |
Escuro, t.a., até 2 horas |
? |
PEP |
Agarose |
50 mg L-Gly-Leu (Sigma G-2002) + 20 mg PER (Sigma P-8125) + 16 mg o-dianisidina (Sigma D-3252) + 20 mg a.a.-oxidase (Sigma V-7000) |
2 mL Tris 1 M pH 8,5 + 8 mL água + 10 mL agarose |
? |
? |
PER |
Imersão |
50 mg 3-amino-9-carbazole (Sigma A-5754) |
solução A: dissolver sólido em 1,25 mL N,N'-dimetilformamida (Sigma D-4254); sol. B: 12 mL AcNa 0,1 M pH 5,0 + 84,5 mL água + 2 mL H2O2 3% + 200 μL CaCl2 1 M. Misturar A + B |
t.a., até 2 horas |
bandas vermelho ou vermelho-acastanhado sobre fundo claro |
PFK |
Imersão |
10 mg ATP + 50 mg fructose 6-fosfato + 50 mg arsenato de sódio |
10 mL Tris 1 M pH 8,5 + 89 mL água + 1 mL NAD + 500 U TPI (Sigma T-2391) + 40 U ALD + 40 U GAPD + 50 μL MgCl2 1 M |
Escuro, t.a., 30-60 min. |
Fluorescente |
PGD |
Agarose |
20 mg ácido 6-fosfoglucónico (Sigma P-7627) + 8 mg NADP |
1 mL Tris 1 M pH 8,5 + 7 mL água + 100 μL MgCl2 1 M + 1 mL MTT + 1 mL PMS + 10 mL agarose |
Escuro, t.a., durante a noite |
bandas azul-escuro sobre fundo claro |
PGI |
Agarose |
40 mg fructose 6-fosfato |
2 mL Tris 1 M c/ Mg pH 9 + 5 mL água + 1 mL NAD + 1 mL MTT + 50 U G6PD + 1 mL PMS + 10 mL agarose |
Escuro, 37 ºC, 1–2 horas |
bandas azul-escuro sobre fundo claro |
PGK |
Imersão |
10 mg ácido 3-fosfoglicérico (Sigma G-6251) + 10 mg NADH + 10 mg ATP |
5 mL Tris 1 M pH 8,5 + 45 mL água + 25 μL MgCl2 1 M + 50 U GAPD |
Escuro, t.a., 1-2 horas |
Fluorescência negativa |
PGM |
Agarose |
100 mg α-D-glucose-1-fosfato (Sigma G-1259 [Spencer et al. 1964, May 1991]) |
1 mL Tris 1 M pH 8,5 + 6,5 mL água + 1 mL NAD + 0,5 mL MTT + 60 U G6PD + 1 mL PMS + 10 mL agarose |
Escuro, 37 ºC, 2 horas |
bandas azul-escuro sobre fundo branco |
SKD |
Agarose |
10 mg ácido chiquímico (Sigma S-5375) + 8 mg NADP |
1 mL Tris 1 M pH 8,0 + 7 mL água + 100 μL MgCl2 1 M + 1 mL MTT + 1 mL PMS + 10 mL agarose |
Escuro, 37 ºC, 2 horas, e t.a. durante a noite |
bandas azul-escuro sobre fundo claro |
SOD |
Agarose |
20 mg Nitro Blue Tetrazolium (Sigma N-6876) |
2 mL Tris 1 M pH 8,5 + 1 mL NAD + 4 mL água + 3 mL PMS + 10 mL agarose |
t.a., durante a noite, protegido da evaporação |
Foto-oxidação do PMS excepto onde houver actividade (contraste negativo, bandas amareladas sobre fundo arroxeado). NAD facultativo (mas menos bandas) |
XDH |
Imersão |
60 mg hipoxantina (Sigma H-9377) |
10 mL Tris 1 M pH 8,5 + 88 mL água + 1 mL MTT + 1 mL PMS |
Escuro, 37 ºC, 2 horas, e t.a. durante a noite |
? |