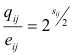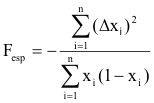Apêndice II: estudos diversos
A — Filogenia dos Quercus, simplificada
Baseada na figura 4 de Manos et al. [2001], com remoção das hierarquias não-significativas e
restrita ao género Quercus, a figura 6.1 representa o parentesco provável, baseado em sequências do
DNA, entre diversas espécies mencionadas no presente trabalho.
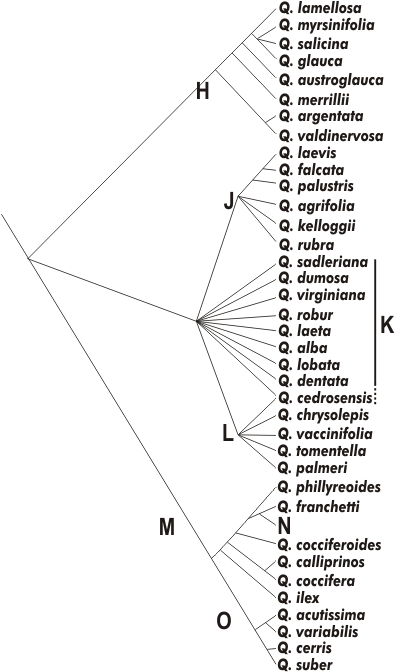 Figura 6.1 — Topologia
filogenética do género Quercus
(dendrograma de consenso
estrito) [Manos et al. 2001]. O
grupo de referência (outgroup)
mais próximo é o que inclui
Castanea (figura 2.2). A
extensão de cada segmento não
representa quantitativamente a
distância entre os táxones. As
letras designam alguns clades: H
— subgénero Cyclobalanopsis
(os restantes clades, J–K–L–M,
constituem o subgénero
Quercus, parafilético neste
esquema); J — secção Lobatæ;
K — secção Quercus s.s.; L —
secção Protobalanus (espécies
não resolvidas); M — secção
Cerris; N — subsecção
Brachylipedes (que inclui Q.
pseudosemicarpifolia, Q.
senescens, Q. rhoderiana, Q.
guajavifolia, Q. longispica, Q.
angleriana, Q. spinosa, Q.
monimotricha e Q. pannosa); O
— subsecção Cerris. Não se
incluem os autores adoptados
para cada táxone, que podem ser
consultados no apêndice do
original.
Figura 6.1 — Topologia
filogenética do género Quercus
(dendrograma de consenso
estrito) [Manos et al. 2001]. O
grupo de referência (outgroup)
mais próximo é o que inclui
Castanea (figura 2.2). A
extensão de cada segmento não
representa quantitativamente a
distância entre os táxones. As
letras designam alguns clades: H
— subgénero Cyclobalanopsis
(os restantes clades, J–K–L–M,
constituem o subgénero
Quercus, parafilético neste
esquema); J — secção Lobatæ;
K — secção Quercus s.s.; L —
secção Protobalanus (espécies
não resolvidas); M — secção
Cerris; N — subsecção
Brachylipedes (que inclui Q.
pseudosemicarpifolia, Q.
senescens, Q. rhoderiana, Q.
guajavifolia, Q. longispica, Q.
angleriana, Q. spinosa, Q.
monimotricha e Q. pannosa); O
— subsecção Cerris. Não se
incluem os autores adoptados
para cada táxone, que podem ser
consultados no apêndice do
original.
B — Proporção de substituições de aminoácidos com mudança de carga
eléctrica
Os aminoácidos com carga eléctrica são R, K e H (carga positiva), e D e E (carga negativa).
Qualquer substituição envolvendo perda, ganho ou inversão de carga eléctrica terá de envolver um
destes, e são principalmente essas substituições as que são detectáveis nas electroforeses em amido. Há
162 substituições desse tipo (43% num total de 380), sendo em número de 12 as que produzem uma
inversão de carga e têm por isso o dobro do efeito na migração através do gel.
As matrizes BLOSUM permitem estimar a probabilidade qij/eij de substituição dum aminoácido
i por um aminoácido j, cada matriz respeitando a uma determinada percentagem de homologia entre
proteínas (isto é, diferentes graus de divergência filogenética). Como cada elemento sij da matriz é
2log2(qij/eij), obtêm-se os valores das probabilidades pela operação inversa, ou seja,
Para calcular a proporção de substituições com alteração da carga, obtiveram-se as médias
harmónicas dos quocientes qij/eij para o conjunto de todas as substituições e para as que envolvem
alteração de carga, multiplicadas pelas respectivas frequências (tabela 6.1)
Tabela 6.1 — Estimativa da proporção de substituições que envolvem mudança de carga. Note-se
que o facto duma substituição implicar mudança de carga torna-a apenas um pouco menos provável (B)
do que para as substituições em geral (A). A matriz BLOSUM 62 refere-se a blocos de sequências de
aminoácidos homólogos a pelo menos 62%, a BLOSUM 90 idem a 90%, e a BLOSUM 100 a sequências
idênticas.
|
BLOSUM 62
|
BLOSUM 90
|
BLOSUM 100
|
qij/eij global = A
|
0,5401
|
0,3744
|
0,1593
|
qij/eij mudança de carga = B
|
0,5158
|
0,3457
|
0,1405
|
162B/380A
|
40,7%
|
39,4%
|
37,6%
|
Os cálculos resumidos na tabela 6.1 sugerem que a probabilidade se encontra próximo dos 40%,
ligeiramente menos se se tratar de tempos de divergência muito recentes.
Fonte utilizada para as matrizes:
ftp://ftp.ncbi.nlm.nih.gov/blast/matrices/
Referência adicional:
http://helix.biology.mcmaster.ca/721/distance/node10.html
C — Coeficiente de fixação esperado (Fesp, tabela 4.32)
Considerando um locus de n alelos, definem-se 3 distribuições de frequência para os gâmetas
femininos (x'1, x'2, ..., x'n), masculinos (X1, X2, ..., Xn) e diplóides deles resultantes (x1, x2, ..., xn).
Em panmixia, xi = ½ (x'i + Xi), de modo que pode definir-se Δxi = Xi – xi = – (x'i – xi).
A proporção de homozigóticos resultantes da conjugação é 1 – He = Σi x'iXi = Σi (xi – Δxi)(xi + Δxi)
= Σi (xi)2 – Σi (Δxi)2. Notando que existe um desvio Σi (Δxi)2 de sinal negativo em relação à expectativa de
Hardy-Weinberg, o coeficiente de fixação a esperar Fesp é negativo, podendo calcular-se resolvendo a
seguinte equação:
Σi (xi)2 – Σi (Δxi)2 = Σi (xi)2 + [Σi xi(1 – xi)]Fesp,
donde
D — Simulação das linhagens derivadas dos híbridos
Considere-se um híbrido entre sobreiro e azinheira, F1, cuja fertilidade com pólen de sobreiro,
azinheira e de F1 (incluindo ser autopolinizado) se traduz numa distribuição na descendência (F2) de pS1
retrocruzados com sobreiro (linhagem XS), pA1 retrocruzados com azinheira (linhagem XA), e pX1 com
F1 (incluindo selfing, linhagem XX), pS1 + pA1 + pX1 = 1.
Os indivíduos XS contêm em média 75% de genoma nuclear de sobreiro e 25% do de azinheira.
Assumindo que estas percentagens são iguais, respectivamente, a pS2 e pA2 (isto é, às probabilidades de
produzirem descendência retrocruzando com sobreiro ou azinheira), e que pX2 ≈ 0 (assumindo que a
fertilidade com pólen de F1 é desprezável quando o conteúdo médio em genoma de sobreiro ou azinheira
é diferente de 50%), então resultam na F3 desta linhagem 75% de indivíduos XSS e 25% XSA, com
87,5% e 37,5% de genoma nuclear de sobreiro, respectivamente. Usando raciocínio análogo deduzem-se,
na F3 descendente dos XA, 75% XAA com 37,5% em média de genoma nuclear de sobreiro e 25% com
87,5%. No caso dos XX, assume-se pS2 = pS1, pA2 = pA1 e pX2 = pX1.
Se se considerar que todas as linhagens são igualmente férteis, produz-se na geração Fn um número
2n–2 de combinações diferentes nas linhagens dos XS, idem nas dos XA, e 2n–1–1 nas linhagens dos XX.
Por exemplo na F4, e considerando pS1 = pA1 = ½(1 – pX1), pX1 = 10% (cf. tabela 4.18) a distribuição
de linhagens é a seguinte:
linhagem
|
XSSS
|
XSSA
|
XSAS
|
XSAA
|
XASS
|
XASA
|
XAAS
|
XAAA
|
XXSS
|
XXSA
|
XXAS
|
XXAA
|
XXXS
|
XXXA
|
XXXX
|
% genoma Sb
|
93,8
|
43,8
|
68,8
|
18,8
|
81,3
|
31,3
|
56,3
|
6,3
|
87,5
|
37,5
|
62,5
|
12,5
|
75,0
|
25,0
|
50,0
|
frequência (%)
|
29,5
|
4,2
|
4,2
|
7,0
|
7,0
|
4,2
|
4,2
|
29,5
|
3,4
|
1,1
|
1,1
|
3,4
|
0,5
|
0,5
|
0,1
|
Nota-se que as linhagens mais frequentes são também as que contêm os valores mais extremos de
percentagem de genoma de sobreiro. A distribuição na F5 é ilustrada na figura 6.2.
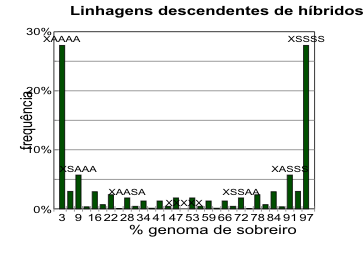 Figura 6.2 — Resultados da simulação na F5, conforme o
modelo que é exposto no texto.
Figura 6.2 — Resultados da simulação na F5, conforme o
modelo que é exposto no texto.
É natural que, pela variação do conteúdo em genoma nuclear de sobreiro dentro de cada linhagem,
uma proporção das classes extremas inclua azinheiras e sobreiros “puros”, mas a questão que mais deve
interessar no contexto do presente estudo é: quantas gerações são necessárias para aparecerem
“azinheiras” e “sobreiros” a partir duma F1? Na figura 6.3 responde-se para diferentes valores arbitrários
de percentagem de genoma nuclear de sobreiro.
 Figura 6.3 — Frequência de indivíduos com
uma percentagem de genoma de sobreiro superior a
um determinado critério arbitrário de definição do
que é aparentemente “sobreiro”. Note-se que, pela
simetria das distribuições (cf. figura 6.2), o resultado
é idêntico para a frequência de “azinheiras”.
Figura 6.3 — Frequência de indivíduos com
uma percentagem de genoma de sobreiro superior a
um determinado critério arbitrário de definição do
que é aparentemente “sobreiro”. Note-se que, pela
simetria das distribuições (cf. figura 6.2), o resultado
é idêntico para a frequência de “azinheiras”.
E — Estudos sobre o pólen dos híbridos
1) Fenologia da floração
Durante a época de floração de 2003, foi feito o acompanhamento da floração das seguintes
árvores:
Sobreiros (de floração precoce): M01, M09, M14, M27, M32, M35, M40, M50, M61
Azinheiras (de floração tardia): M55, M60, M64; (precoce): M04, M15, M41, M51, M58
Híbridos: ALC, CAB, MRM, SES, SM1, SM2, SM4, TES, VR
TES refere-se à Herdade de Testos, São Pedro da Gafanhoeira (Arraiolos), uma árvore jovem de
casca fina, localizada à latitude 38º44.1'N e longitude 8º04.0'W (Apêndice I, secção A2). Não existe
confirmação por marcadores isoenzimáticos se se trata de facto dum híbrido, mas os caracteres
morfológicos são totalmente concordantes (cf. “Revisão bibliográfica” parte III, secção C).
Na tabela 6.2 apresentam-se as observações realizadas, e na figura 6.4 um resumo das datas médias
de passagem por cada fase em cada grupo, excepto para o caso duma azinheira excepcionalmente tardia,
M64. Os híbridos situam-se quase equidistantemente entre as azinheiras tardias (II) e os sobreiros
precoces, mas individualmente há também uma grande dispersão, nomeadamente com a precocidade de
SES. É de supor que a floração masculina de TES e VR a atingir a fase F2 tenha sido nula ou quase.
Tabela 6.2 — Fases fenológicas (floração masculina) observadas em azinheiras, híbridos e
sobreiros, durante a época de floração da Primavera de 2003 (4 de Abril a 16 de Maio). A subdivisão das
azinheiras entre precoces e tardias foi feita a priori, com base em observações precedentes do projecto
PAMAF 8153 em 1998 e 2000 [M. C. Varela, comunicação pessoal].
|
Árvore
|
04-Abr
|
11-Abr
|
16-Abr
|
24-Abr
|
30-Abr
|
08-Mai
|
16-Mai
|
|
M4
|
F
|
F/F2/G
|
—
|
G
|
—
|
—
|
—
|
M15
|
G?
|
G
|
—
|
G
|
—
|
—
|
—
|
M41
|
F/F2
|
F/F2/G
|
—
|
G
|
—
|
—
|
—
|
M51
|
F2
|
F/F2
|
—
|
F2
|
—
|
—
|
—
|
M58
|
F(F2)
|
(F)F2/G
|
—
|
G
|
—
|
—
|
—
|
|
M55
|
D
|
E
|
—
|
F/F2
|
—
|
G+
|
—
|
M60
|
E
|
F
|
—
|
F2/G
|
—
|
G+
|
—
|
M64
|
nada
|
nada
|
—
|
C/D
|
—
|
F/F2
|
H?
|
|
SES
|
D/E
|
F
|
F/F2
|
(F2)G
|
—
|
—
|
—
|
SM1
|
nada
|
(D/E)
|
C/D(E/F)
|
D/E(F)
|
—
|
(F/F2)
|
—
|
SM2
|
C
|
D
|
D/E
|
E/F
|
—
|
(F/F2)G
|
—
|
SM4
|
nada
|
—
|
—
|
—
|
—
|
F2/G
|
—
|
MRM
|
nada
|
—
|
D
|
—
|
E/F
|
—
|
G
|
VR
|
nada
|
—
|
(D/E)
|
F
|
(F)
|
—
|
—
|
CAB
|
C/D
|
—
|
F
|
F(F2)
|
F2
|
—
|
—
|
ALC
|
nada
|
|
D
|
F
|
G
|
|
|
TES
|
C
|
|
E
|
F
|
(F)
|
|
|
|
M1
|
nada
|
|
|
E
|
|
F2
|
G
|
M9
|
nada
|
|
|
E/F(F2)
|
|
F/F2
|
G
|
M14
|
nada
|
|
|
E(F)
|
|
(F2)G
|
G
|
M27
|
nada
|
|
|
D
|
|
F2/G
|
G
|
M32
|
nada
|
|
|
E/F(F2)
|
|
G
|
|
M35
|
nada
|
|
|
D
|
|
G
|
|
|
M40
|
nada
|
|
|
E
|
|
G
|
|
|
M50
|
nada
|
|
|
D
|
|
F(F2)
|
(F2)G
|
|
M61
|
nada
|
|
|
E
|
|
F(F2)
|
F2
|
 Figura 6.4 — Fenologia da floração, representada pelas
datas médias de cada fase, calculadas entre os diferentes
indivíduos de cada grupo considerado na tabela 6.2, excluída a
M64 (azinheira II).
Figura 6.4 — Fenologia da floração, representada pelas
datas médias de cada fase, calculadas entre os diferentes
indivíduos de cada grupo considerado na tabela 6.2, excluída a
M64 (azinheira II).
2) Dimensões do grãos de pólen de híbridos
Uma parte da amostragem mencionada na secção anterior serviu para recolher amostras de pólen
com vista à determinação das dimensões dos grãos de pólen dos híbridos. Para tal, recolheram-se ramos
amentíferos em fase Fm2 (ou transitando de Fm para Fm2), cuja haste era mergulhada dentro de
recipientes com água, protegidos da agitação do ar, e após alguns dias o pólen sacudido sobre papel
branco e recolhido dentro de tubos de 1,5 mL, mantidos a –20 ºC até posteriores manipulações [M. C.
Varela, comunicação pessoal].
As preparações de grãos de pólen para microscopia seguiram um procedimento que é considerado
em taxonomia particularmente adequado para medições rigorosas [Rodford et al. 1974].
Materiais utilizados
Glicerina gelatinada: embebição de 4 g de gelatina em pó com água fria dentro duma placa de
Petri, primeiro espalhando o pó progressivamente sobre a água e depois mantendo durante a noite a 4
ºC; transferência da papa compacta resultante para um gobelet para derreter em banho-maria a 60 ºC,
adicionando-se depois 6 mL de glicerol a 87% e 110 mg de fenol (cristais), misturando-se, e filtrando-se
através de gaze para um frasco escuro. A solução é guardada à temperatura ambiente, gelificada e
protegida da luz, derretendo-se em banho-maria cada vez que fosse necessário. Verde de metilo e floxina
B: soluções saturadas em etanol a 50%, mantidas em tubo de 1,5 mL à temperatura ambiente e protegidos
da luz. Meio de montagem: 1 mL de glicerina gelatinada (derretida) com 50 µL de verde de metilo e 40
µL de floxina B.
Montagem das preparações
i) Colocar uma pequena quantidade de pólen (não muito pequena!) no centro da lâmina;
ii) Juntar 1 gota de álcool a 70% e deixar evaporar parcialmente (repetir com mais gotas se
necessário)
iii) Limpar anel de óleos eluídos em algodão embebido em álcool
iv) Adicionar 1 gota (30 a 40 µL) de meio de montagem e mexer dentro dela o pólen (manter a
lâmina quente!)
v) Cobrir com a lamela e aquecer brevemente
As preparações estão boas para observar só ao fim de 3 dias, com a exina corada de verde
esmeralda e o restante material de carmim (figura 6.5).
Observação e medições
Os grãos de pólen dos Quercus são, na perspectiva polar, angulaperturados ou goniotremas, com
um perfil equatorial triangular. Noutras perspectivas, o perfil é circular ou elíptico (figura 6.5). As
medições fizeram-se sobre perfis de tipo circular ou elíptico, estes últimos no eixo menor. Prepararam-se
2 lâminas por indivíduo, medindo-se 30 grãos de pólen em cada uma com ampliação de 1000× e ocular
micrométrica calibrada, num microscópio Olympus BX50.
Também se notaram em todas as preparações o que parece serem restos de grãos de pólen apenas
com a exina (corada de verde), sem conteúdo citoplásmico (figura 6.5 a). A percentagem de grãos de
pólen “intactos” foi determinada num campo óptico de cada preparação, excepto na primeira de ALC por
nesta haver tão pouco material disponível.
Resultados
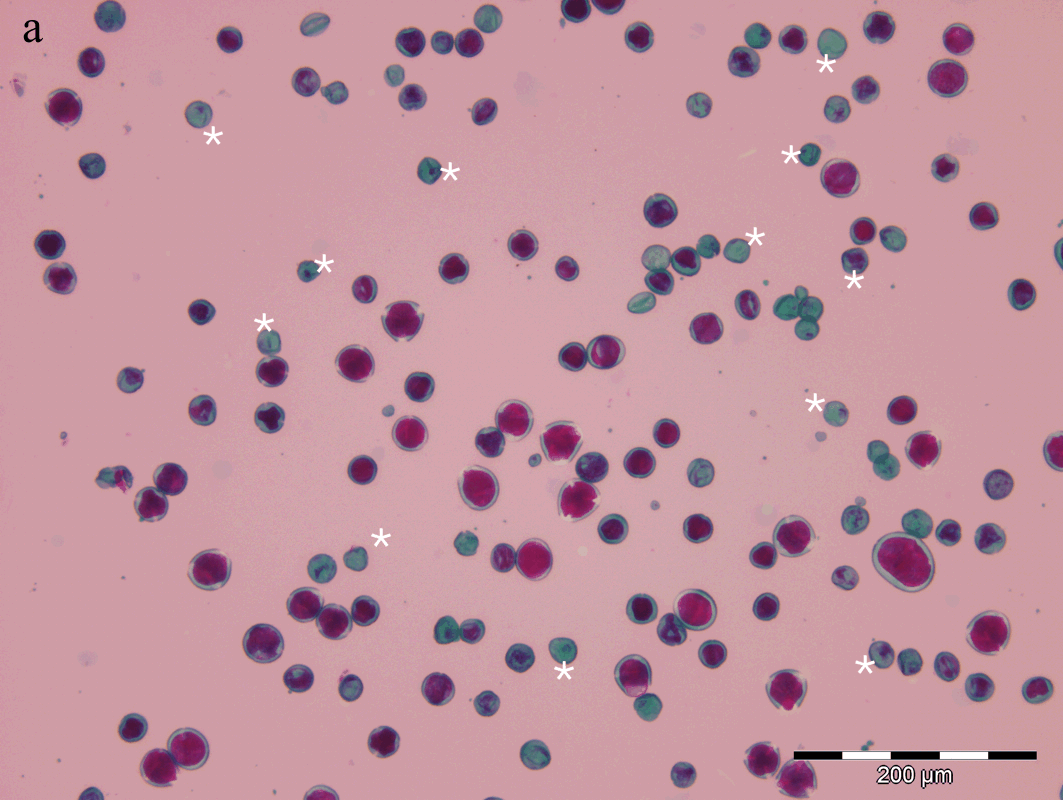

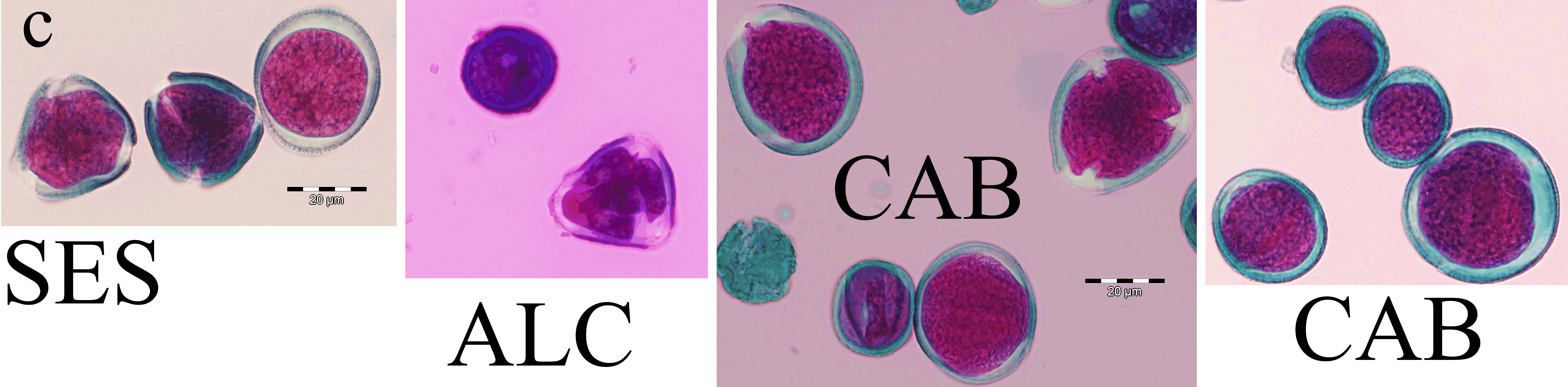 Figura 6.5 — Imagens de grãos de pólen de híbridos. a) Panorâmica duma
preparação (de CAB), ampliação original 100×, observando-se várias figuras
apenas com a coloração verde da exina (algumas são assinaladas com
asteriscos). b) Dois exemplos (de SES), um em perspectiva equatorial com
perfil elíptico, outro em perspectiva polar, ilustrando o perfil triangular,
ampliação original 600× (imersão). c) Composição de imagens de diferentes
preparações de SES, ALC e CAB, ampliação original 600× (imersão). Barras
de calibração, 200 μm (a) e 20 μm (b, c). Fotos obtidas com câmara digital
Olympus DP70 acoplada ao microscópio, com correcção de exposição e cor
usando o software Olympus DP-Soft, versão 3.2, em ambiente Windows XP.
Figura 6.5 — Imagens de grãos de pólen de híbridos. a) Panorâmica duma
preparação (de CAB), ampliação original 100×, observando-se várias figuras
apenas com a coloração verde da exina (algumas são assinaladas com
asteriscos). b) Dois exemplos (de SES), um em perspectiva equatorial com
perfil elíptico, outro em perspectiva polar, ilustrando o perfil triangular,
ampliação original 600× (imersão). c) Composição de imagens de diferentes
preparações de SES, ALC e CAB, ampliação original 600× (imersão). Barras
de calibração, 200 μm (a) e 20 μm (b, c). Fotos obtidas com câmara digital
Olympus DP70 acoplada ao microscópio, com correcção de exposição e cor
usando o software Olympus DP-Soft, versão 3.2, em ambiente Windows XP.
Tabela 6.3 — Estatísticas (valores mínimo e máximo, média, desvio-padrão da amostra) obtidas
das medições feitas aos grãos de pólen de 2 sobreiros, 2 azinheiras e 3 híbridos. O valor de probabilidade
(P) refere-se ao teste t de Student visando verificar se as médias nas duas preparações do mesmo pólen
são heterogéneas (*, P < 0,05).
|
|
sobreiros
|
azinheiras
|
híbridos
|
|
|
M09
|
M61
|
M51
|
M58
|
ALC
|
CAB
|
SES
|
|
mín–máx.
|
22–36
µm
|
22–35
µm
|
21–25
µm
|
21–28
µm
|
18–31
µm
|
20–30
µm
|
20–32 µm
|
média
|
27,4 µm
|
27,4 µm
|
23,5 µm
|
23,8 µm
|
24,5 µm
|
24,0 µm
|
25,4 µm
|
desv.-p.
|
3,1 µm
|
3,7 µm
|
1,1 µm
|
1,8 µm
|
3,6 µm
|
2,6 µm
|
2,9 µm
|
|
mín–máx.
|
24–34
µm
|
22–35
µm
|
19–26
µm
|
21–26
µm
|
19–30
µm
|
20–28
µm
|
20–35 µm
|
média
|
28,9 µm
|
29,2 µm
|
23,3 µm
|
23,1 µm
|
22,6 µm
|
23,3 µm
|
25,9 µm
|
desv.-p.
|
2,7 µm
|
2,9 µm
|
1,4 µm
|
1,5 µm
|
2,4 µm
|
1,8 µm
|
3,8 µm
|
|
P
|
0,046 *
|
0,035*
|
0,474
|
0,099
|
0,025*
|
0,239
|
0,568
|
mín–máx.
|
22–36
µm
|
22–35
µm
|
19–26
µm
|
21–28
µm
|
18–31
µm
|
20–30
µm
|
20–35 µm
|
média
|
28,1 µm
|
28,3 µm
|
23,4 µm
|
23,4 µm
|
23,6 µm
|
23,6 µm
|
25,6 µm
|
desv.-p.
|
3,0 µm
|
3,4 µm
|
1,2 µm
|
1,6 µm
|
3,2 µm
|
2,3 µm
|
3,3 µm
|
Através do teste t de comparação entre médias, verificou-se homogeneidade entre as amostras de
sobreiro (P = 0,75), e entre as de azinheira (P = 0,90), e ainda entre ALC e CAB (P = 0,90), mas o valor
médio de SES é heterogéneo em relação ao dos outros 2 híbridos (ANOVA simples, F2;177 = 9,62, P =
0,01%). Conforme é já conhecido dos palinologistas [Brandão 1996], os grãos de pólen de azinheira são
mais pequenos que os de sobreiro, e também de dimensões mais homogéneas, e os dos híbridos
assemelham-se mais aos de azinheira, embora com maior variação (figura 6.6).
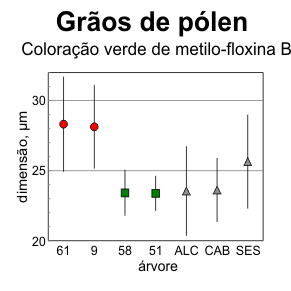 Figura 6.6 — Dimensões dos grãos de pólen,
ilustrando os valores médios + desvio-padrão para
cada árvore (60 observações cada).
Figura 6.6 — Dimensões dos grãos de pólen,
ilustrando os valores médios + desvio-padrão para
cada árvore (60 observações cada).
As contagens de grãos de pólen “intactos” em cada preparação veio a revelar um contraste entre
os híbridos e as restantes árvores, pois enquanto nestas a percentagem ficou acima dos 90%, naqueles
nunca foi além dos 71% (tabela 6.4). O padrão observado parece excluir qualquer hipótese de artefacto
relacionado com as manipulações feitas, antes sugerindo uma maior taxa de abortamento dos grãos de
pólen nos híbridos [Rushton 1993].
Tabela 6.4 — Determinação da percentagem de grãos de pólen “intactos”, isto é, com a exina
(verde de metilo) e o citoplasma (carmim) presentes, em cada preparação. n. r., não realizada.
Árvore
|
61
|
9
|
58
|
51
|
ALC
|
CAB
|
SES
|
Preparação
|
1
|
2
|
1
|
2
|
1
|
2
|
1
|
2
|
1
|
2
|
1
|
2
|
1
|
2
|
“intactos”
|
171
|
279
|
342
|
115
|
151
|
79
|
261
|
186
|
n. r.
|
49
|
126
|
156
|
140
|
250
|
total
|
178
|
304
|
360
|
121
|
159
|
88
|
289
|
191
|
n. r.
|
80
|
195
|
240
|
197
|
395
|
%
|
96
|
92
|
95
|
95
|
95
|
90
|
90
|
97
|
n. r.
|
61
|
65
|
65
|
71
|
63
|
F — Nomenclatura botânica para a azinheira ibero-magrebina (variante
‘rotundifolia’)
Há na realidade duas questões a considerar: qual o binómio lineano correcto, isto é, se a distinção
em relação ao tipo de Q. ilex L. (variante ‘ilex’) é ao nível da espécie ou ao nível infra-específico; e, na
segunda possibilidade, qual o epíteto infra-específico correcto.
1) Binómio específico
Referências nomenclaturais mais relevantes [Rothmaler 1941, Vasconcelos & Franco 1954, Franco
1990]:
Quercus ilex L. 1753
Quercus rotundifolia Lam. 1785
Quercus ballota Desf. 1790
Abstraindo dos caracteres foliares, a distinção entre a variante ‘ilex’ e a ‘rotundifolia’ só existe
ao nível do perianto masculino [Franco 1990]: ângulo na extremidade dos lóbulos (ovado-agudos vs.
ovado-obtusos, respectivamente) e vilosidade na ântese, esta apenas em ‘ilex’ e sem ser constante. No
entanto, Rothmaler [1941] acrescenta diferenças na copa («ramos por fim pendentes» na ‘rotundifolia’)
e nos estigmas («muito mais largos»).
A espécie mais próxima para a qual foi possível obter uma descrição detalhada, por um mesmo
autor [Franco 1990], é Q. coccifera (figura 6.1): usando o mesmo método, a distinção entre ‘ilex’ e Q.
coccifera (os estados de carácter citados são deste último) verifica-se: na casca (lisa), no tomento dos
rebentos (ralo e precocemente caduco), nas gemas (1-2 mm, glabrescentes), nos amentos masculinos
(podem ser abaixo de 3 cm e o ráquis é glabrescente), no perianto masculino (lóbulos ciliados), nas
anteras (papilosas e mais curtas que os filetes), nos estigmas (não-claviformes), na maturação do aquénio
(pode ser bienal), no pedúnculo frutífero (pode ser abaixo de 8 mm, glabro) e nas escamas da cúpula
(ovado-lanceoladas, prolongadas em ponta rígida e picante, reflexas).
Apesar de ser mais adequado comparar com espécies ainda mais próximas da variante ‘ilex’,
designadamente Q. baloot Griff. [Schwarz 1936], a comparação com Q. coccifera parece justificar
considerarem-se as variantes ‘ilex’ e ‘rotundifolia’ da mesma espécie, adoptando-se para ambas o
binómio mais antigo (Q. ilex L.). Caso contrário, adopta-se Q. rotundifolia Lam., e o nome dos híbridos
de sobreiro e desta azinheira chamam-se Q. × mixta Vill. ex Colm. (1888).
Um dos conceitos aceites para subespécie [Lawrence 1951, pág. 54] é perfeitamente conforme a
este caso: «variante morfológica principal de uma espécie com distribuição geográfica própria, distinta
das áreas ocupadas por outras subespécies da mesma espécie». De facto, a distinção entre as variantes
‘ilex’ e ‘rotundifolia’ reside em caracteres morfológicos (essencialmente as folhas) e na distribuição
geográfica [De Candolle 1864, Rothmaler 1941, Vasconcelos & Franco 1954, Franco 1990]. Por outro
lado, as diferentes exigências climáticas de ‘ilex’ e ‘rotundifolia’ correspondem à distinção entre
ecótipos, que é um nível biossistemático infra-específico [Lawrence 1951].
A listagem de Govaerts & Frodin [1998] adopta Q. rotundifolia Lam. como válido,
presumivelmente em concordância com Schwarz [1936], o que implica a separação em duas espécies
mas, face aos argumentos acima, ela não é seguida no presente trabalho. Pelo menos uma publicação de
Schwarz evidencia a tendência deste autor para elevar o nível taxonómico dos táxones dentro dos
Quercus (também discutida na “Revisão bibliográfica”, parte I, secção A1, a propósito dos subgéneros):
das seis espécies novas por ele propostas em 1935 [Schwarz 1935], duas (Q. estremadurensis, Q.
bornmuelleriana) distinguem-se ao nível de subespécie dentro doutras espécies, outras duas (Q.
esculiformis, Q. sintenisiana) são meros sinónimos, e outra (Q. cerridolepis) não é reconhecida, mas sem
estar esclarecida a sua sinonímia [Govaerts & Frodin 1998].
2) Epíteto infraspecífico
Considerando a distinção ao nível de subespécie, a variante ‘ilex’ é a autónima e designa-se Q.
ilex L. subsp. ilex. Quanto à variante ‘rotundifolia’, as referências nomenclaturais mais relevantes são
[Morais 1940, Vasconcelos & Franco 1954, Franco 1990, Govaerts & Frodin 1998]:
Q. ilex var. ballota (Desf.) Camb 1827
Q. ballota var. rotundifolia (Lam.) Webb 1838
Q. ilex var. rotundifolia (Lam.) Trab. 1905
Q. ilex subsp. ballota (Desf.) Samp. 1909
Q. ilex subsp. rotundifolia (Lam.) Schw. ex Tab. Morais 1940
De acordo com o Código Internacional de Nomenclatura Botânica de St. Louis, 1999, o epíteto
infra-específico mais antigo para a espécie respectiva é o que é válido (artº 11.4), e recomenda-se que
o epíteto a atribuir a uma subespécie não autónima seja o de uma das variedades a ela subordinadas
(recomendação 26A.2); além disso, o autor será aquele que fez a descrição ou diagnose que validaram
esse epíteto (artigo 46.4), e a reclassificação sem alteração do nível taxonómico não pode alterar essa
autoria (artigo 49). A referência de 1827 está incluída numa enumeração de espécies das ilhas Baleares
feita por Jacques Cambessèdes, e é interessante porque as duas variantes estão presentes nestas ilhas
[Rothmaler 1941], mas não foi possível verificar se inclui uma diagnose ou descrição, ou como justifica
a distinção a nível infra-específico (observações de hibridismo?). Considerando que lhe é equivalente
a designação feita por De Candolle em 1864, associada a uma correcta distinção morfológica e
geográfica [Vasconcelos & Franco 1954], deduz-se que o trinómio a adoptar-se seja Q. ilex subsp.
ballota (Desf.) Camb., ou quando muito terminada com Camb. ex A. DC. (apesar de De Candolle não
fazer referência a Cambessèdes); porém, neste caso, levantar-se-ia a questão da prioridade da designação
Q. ilex subsp. rotundifolia (Lam.) Webb..
A recomendação 24B.2 do mesmo Código (retenção do epíteto final da espécie quando um táxone
passa desse nível para o de subespécie) teria de aplicar-se em 1827 e não actualmente.
Conclui-se assim que nem a designação adoptada na Flora Iberica (a de 1909), nem a adoptada
por Vasconcelos & Franco e pela Flora Europæa (a de 1940, em ambos os casos ignorando a referência
“Schwz. ex”), teriam prioridade; além disso, verifica-se que ambas têm bases surpreendentemente
frágeis: na Flora Iberica justifica-se que a designação original de “raça” seria assimilável à de
subespécie [Franco 1990], porém ela foi originalmente atribuída às azinheiras de bolota doce [Sampaio
1909], o que entretanto ficou claro ser apenas uma variante ao nível da forma, existente tanto em ‘ilex’
como em ‘rotundifolia’ [Morais 1940, Vasconcelos & Franco 1954]; além disso, a autoria de 1864 (se
não a de 1827), actualizada para subespécie, teria prioridade. Assim, a designação adoptada na Flora
Iberica parece ilegítima.
Quanto à designação de 1940, é um mistério por que razão Taborda Morais (que precedentemente
utilizava Q. ilex var. ballota (Desf.) [Morais 1936]), atribui a Schwarz a autoria pois indirectamente se
deduz que este se mantinha nessa altura com a distinção Q. rotundifolia Lam. [Rothmaler 1941]. Talvez
por isso seja corrente a autoria estar com Schwz. ex Tab. Morais [Govaerts & Frodin 1998], mas mesmo
essa não é validada, porque a primeira descrição e diagnose sob este nome, e ainda discussão detalhada
do problema taxonómico, é feita por Vasconcelos e Franco em 1954
 .
.
3) Conclusão
É evidente que a designação Quercus ilex subsp. rotundifolia (Lam.) Schw. ex Tab. Morais só se
mantém por inércia. O definitivo esclarecimento da nomenclatura correcta terá de ser feito pela
verificação da prioridade da designação de 1827 e, em caso negativo, da de 1838. Se ambas não tiverem
validade, e dentro da premissa que se trata duma distinção a nível subespecífico em relação ao tipo de
Q. ilex, então a designação Quercus ilex subsp. ballota (Lam.) A. DC. é seguramente a que deve ser
adoptada. Contudo, e na persistência de incertezas, e visto que se trata duma designação não adoptada,
parece o mais sensato manter-se a designação de 1940, se bem que esta inércia não seja tolerável a prazo.
Um especial agradecimento pelas produtivas discussões mantidas com a Drª Carla Cruz
(Departamento de Biologia, Universidade de Lisboa), Profª Ana Isabel Correia e Drª Alexandra
Escudeiro (Museu e Jardim Botânico da Universidade de Lisboa).
Referências adicionais:
http://www.bgbm.fu-berlin.de/iapt/nomenclature/code/SaintLouis/0000St.Luistitle.htm
(International Code of Botanical Nomenclature (St Louis Code, 1999). Regnum Vegetabile 138. W.
Greuter, Chairman. Koeltz Scientific Books, Königstein, 2000)
Cambessèdes, J., 1827 — Enumeratio Plantarum quas in insulis Balearibus collegit pág. 137,
reimpress. ex Mem Mus. Hist. Nat. Paris, 14
De Candolle, A., 1864 — Prodr. Vol. 16 Tomo 2 pág. 39.
Morais, A. T., 1936 — Notas sobre a flora portuguesa. Bol. Soc. Brot. Série II Vol. 11 pág. 162.
Morais, A. T., 1940 — Novas áreas da fitogeografia portuguesa. Bol. Soc. Brot. (II) Vol. 14 pp.
97-138.
Sampaio, G., 1909 — Bol. Soc. Brot. Série I Vol. 24 pág. 102.
Schwarz, O., 1935 — Einige neue Eichen des Mediterrangebiets und Vorderasiens. Notizbl. Bot.
Gart. u. Mus. zu Berlin-Dahlem Vol. 12 pp. 461-469.
 Figura 6.1 — Topologia
filogenética do género Quercus
(dendrograma de consenso
estrito) [Manos et al. 2001]. O
grupo de referência (outgroup)
mais próximo é o que inclui
Castanea (figura 2.2). A
extensão de cada segmento não
representa quantitativamente a
distância entre os táxones. As
letras designam alguns clades: H
— subgénero Cyclobalanopsis
(os restantes clades, J–K–L–M,
constituem o subgénero
Quercus, parafilético neste
esquema); J — secção Lobatæ;
K — secção Quercus s.s.; L —
secção Protobalanus (espécies
não resolvidas); M — secção
Cerris; N — subsecção
Brachylipedes (que inclui Q.
pseudosemicarpifolia, Q.
senescens, Q. rhoderiana, Q.
guajavifolia, Q. longispica, Q.
angleriana, Q. spinosa, Q.
monimotricha e Q. pannosa); O
— subsecção Cerris. Não se
incluem os autores adoptados
para cada táxone, que podem ser
consultados no apêndice do
original.
Figura 6.1 — Topologia
filogenética do género Quercus
(dendrograma de consenso
estrito) [Manos et al. 2001]. O
grupo de referência (outgroup)
mais próximo é o que inclui
Castanea (figura 2.2). A
extensão de cada segmento não
representa quantitativamente a
distância entre os táxones. As
letras designam alguns clades: H
— subgénero Cyclobalanopsis
(os restantes clades, J–K–L–M,
constituem o subgénero
Quercus, parafilético neste
esquema); J — secção Lobatæ;
K — secção Quercus s.s.; L —
secção Protobalanus (espécies
não resolvidas); M — secção
Cerris; N — subsecção
Brachylipedes (que inclui Q.
pseudosemicarpifolia, Q.
senescens, Q. rhoderiana, Q.
guajavifolia, Q. longispica, Q.
angleriana, Q. spinosa, Q.
monimotricha e Q. pannosa); O
— subsecção Cerris. Não se
incluem os autores adoptados
para cada táxone, que podem ser
consultados no apêndice do
original.